Under normale forhold er ozon et gassformet, fargeløst stoff med en skarp lukt. Det antas at lukten av ozon er lukten av frisk luft etter et tordenvær. Dette er sant, men bare hvis konsentrasjonen er svært lav og er en brøkdel av de maksimalt tillatte konsentrasjonene (MPC). En detaljert beskrivelse av de fysisk-kjemiske egenskapene til ozon er vurdert i en rekke arbeider, spesielt. Noen grunnleggende fysiske og kjemiske egenskaper til ozon er gitt i tabell 1.1.
1.1. Grunnleggende fysiske og kjemiske egenskaper til ozon.
Løselighet av ozon i vann
Når ozon løses opp i vann, øker konsentrasjonen gradvis og når grenseverdiene for disse forholdene. Oppløseligheten av ozon i vann kan uttrykkes enten som den såkalte Bunzea-koeffisienten - β, som viser forholdet mellom volumet av oppløst ozon, redusert til normale forhold, til vannvolumet (Voz/Vv), eller i absolutte verdier av oppløst ozon (g/l). I dette tilfellet anses det at oppløsningsprosessen følger Henrys lov, ifølge hvilken mengden oppløst ozon er proporsjonal med trykket av gassformig ozon over løsningen. Denne loven kan skrives som:
Cst = β M Pγ, g/l
Hvor: Cst - ozonløselighet, g/l; β er Bunsen-koeffisienten; M – ozontetthet = 2,14 g/l; Pγ er partialtrykket til ozon i det betraktede gassformige mediet.
Det skal bemerkes at løseligheten av ozon er mye høyere enn de viktigste atmosfæriske gassene - nitrogen og oksygen, men svakere enn slike oksidasjonsmidler som klor og klordioksid.. Løseligheten til ozon øker raskt med synkende vanntemperatur.
Nedbryting av ozon i vann
Samtidig med oppløsningen av ozon i vann skjer dets nedbrytning. Samtidig avhenger hastigheten på dets forfall, så vel som den gjensidige "levetiden", av temperaturen på vannet og hovedsakelig av sammensetningen av vannet - først og fremst av tilstedeværelsen av forskjellige urenheter i vannet , spesielt noen organiske forbindelser og metallioner. Disse bestemmelsene er godt illustrert av dataene vist i figur 1.2. 
Figur 1.2. . Nedbryting av ozon i ulike typer vann ved en temperatur på 20 °C.
- Bidestillat. 2. Destillat. 3. Vann "Fra springen." 4. Filtrert vann fra Zürichsjøen.
Levetiden i en gang destillert vann er 20 minutter, og i vanlig vann noen minutter.
Reaksjonen av ozon med uorganiske stoffer.
Ozon kan reagere med ulike stoffer i vann ved to forskjellige mekanismer: direkte som ozon (i molekylær form) og i form av OH*-radikalet, som oppstår når ozon brytes ned i vann. Det antas at i nøytralt vann er disse 2 reaksjonskanalene fordelt likt. I et surt medium dominerer den molekylære mekanismen, mens i et alkalisk medium en radikal. Siden ozon virker som et oksidasjonsmiddel i kjemiske reaksjoner, kan man bedømme dets oksidasjonsevne etter den såkalte oksidasjonspotensialverdien. Verdien av verdiene av oksidasjonspotensialene til ulike stoffer som er oksidasjonsmidler er gitt i tabell 1.3.
Oksydasjonsmidler |
Oksidasjonspotensial (volt) |
Relaterer oxlit. potensial for OK svette. klor |
Hydroksylradikal |
||
atomært oksygen |
||
Hydrogenperoksid |
||
Hypoklorsyre |
||
klordioksid |
||
Fra tabell 1.3. Det følger at ozon er det sterkeste oksidasjonsmidlet. Av de stabile stoffene er den nest etter fluor, og overgår kraftig klor. Effektiviteten av reaksjonen av ozon med noen uorganiske stoffer kan estimeres ut fra de initiale hastighetene av ozon som interagerer med dem (mer presist, fra de spesifikke reaksjonshastighetene, såkalte hastighetskonstanter eller deres resiproke - reaksjonstider). Delvis er disse dataene presentert i figur 1.3.
Reaksjon av ozon med metaller
Jern- og manganioner oksideres raskt av ozon til jernhydroksid og mangandioksid. Permanganat kan også dannes ved følgende reaksjon: 2Mn +² + 5O3 + 3H2O □ 2MnO4ˉ + 3O2 + 6H + Parallelt med denne prosessen skjer en annen prosess - fjerning av mangan fra løsningen:
2Mn+² +2O3+4H2O □ 2MnO(OH) 2↓ +2O2 + 4H+ Oksydasjonen av mangan-, kobolt- og nikkeloksidioner skjer med hastigheter som tilsvarer hastighetskonstanter i størrelsesorden 1 l/mol sek. Fjerningen av disse metallene skjer i flokkulerings-filtreringsprosesser.Krom kan oksideres til seksverdig krom. Denne prosessen er kompleks og krever spesielle forhold. 5 6 Bly oksideres av ozon PbO2 med en reaksjonshastighetskonstant i størrelsesorden 10 -10 l/mol sek. Metaller som danner komplekser med EDTA, som Pb, Ni, Cd og Mn, gjennomgår først et dekomplekseringstrinn og oksiderer deretter. Slike reaksjoner reproduserer betingelsene for kompleks dannelse av disse metallene med naturlige humussyrer.
Reaksjon av ozon med organiske forbindelser.
Den elektroniske strukturen til ozon er bipolar: på den ene siden er den negativ, på den andre er den positiv. Av denne grunn kan ozon reagere samtidig både elektrofilt og nukleofilt. Vanligvis dominerer den elektrofile mekanismen i reaksjonen av direkte oksidasjon av stoffer med ozon i vann. Kinetikken for forbruk av oppløst ozon av ulike organiske forbindelser ble studert av Hoigne og S.D. Razumovsky. Delvis er disse dataene vist i figuren Det er ganske vanskelig å karakterisere reaksjonen av alle grunnleggende organiske stoffer med ozon. Med tanke på de direkte effektene av ozon, kan noen generelle punkter bemerkes: Mettede alkylforbindelser reagerer veldig sakte med ozon. De fleste klorerte hydrokarboner og til og med umettede hydrokarboner reagerer ikke direkte med ozon. I dette tilfellet er indirekte interaksjon med ozon gjennom OH-radikalet nødvendig. Benzen oksideres veldig sakte av ozon, og polysykliske hydrokarboner er raskere.
Reaksjonstiden for ozon med fenoliske forbindelser er noen få sekunder. Et delvis reaksjonsskjema for fenol er vist i figur 1.5. Fenationet reagerer raskere enn protonert fenol. Det skal bemerkes at hastighetskonstantene er veldig store og nærme for fenoler med forskjellige strukturer. Karboksylsyrer, ketosyrer og en rekke lignende forbindelser er de endelige stabile produktene av prosessen med oksidasjon av organiske stoffer med ozon. Aminer ved nøytrale pH-verdier reagerer veldig sakte med ozon, ved pH > 8 er oksidasjonsreaksjonene raskere. Imidlertid fortsetter oksidasjonsreaksjonene til aminer generelt gjennom OH-radikaler. Kvartære aminer (aromatiske aminer) reagerer raskere med ozon. Alkoholer kan samhandle med ozon og danne hydroperoksider som mellomprodukter. Samtidig oksideres de til karboksylsyrer, mens sekundære alkoholer oksideres til ketoner. Karboksylsyrer med ozon reagerer svakt eller reagerer ikke i det hele tatt.
Merkaptaner oksideres med ozon til sulfonsyrer. Bisulfitter og sulfonforbindelser er mellomprodukter. Svovelholdige aminosyrer (cystein, cestin og metionin) reagerer raskt. Aminosyrer (en komponent av proteiner) reagerer ved en elektrofil mekanisme. Blant plantevernmidler som inneholder estere av fosforsyre, er paration det mest kjente. Ozonering av denne forbindelsen resulterer i paraokson, som er mer giftig enn parathion. Ytterligere ozonering omdanner paraokson til mindre giftige stoffer (for eksempel til nitrofenol, som deretter oksideres til sluttprodukter - nitrater og CO2).
Ved behandling av drikkevann er mekanismen for direkte oksidasjon gjennom ozon i molekylær form den viktigste. Hastighetskonstantene til et stort antall organiske forbindelser med ozon er presentert i en anmeldelse av Hoigne.
- Ozon som inaktiverer av mikroflora.
Som nevnt ovenfor har ozon en kraftig bakteriedrepende og virulent (inaktiverende virus) effekt.I den vitenskapelige litteraturen (spesielt populær) står det ofte at ozon faktisk inaktiverer bakterier og virus mer enn klor (og dette vil bli illustrert nedenfor), men til kvalitative vurderinger må denne fordelen behandles med visse forbehold Effektiviteten til ulike desinfeksjonsmidler er godt illustrert av dataene i figur 2.1.

Figur 2.1. Hastigheten av inaktivering av patogen E-coli av forskjellige inaktiveringsmidler.
For tiden, når man evaluerer effektiviteten til et desinfeksjonsmiddel, brukes det såkalte C x T-kriteriet, dvs. produktet av konsentrasjonen av reagenset og varigheten av virkningen. Det kan sies at EKSPONERING (INAKTIVERING) = Konsentrasjon Eksponeringstid Tabell 2.1. CxT-verdier er presentert for sammenligningskriterier for ulike mikroorganismer - desinfeksjonsmidler Tabell 2.1. Verdien av CxT-kriteriet for ulike mikroorganismer (99 % inaktivering ved 5-25 ° C. CxT-kriterium (Mb / l min))
Type mikroorganismer |
Ozon pH:6/7 |
Fri klor pH:6/7 |
Kloramin pH: 8/9 |
Klordioksid pH:6/7 |
Poliovirus |
||||
Rotavirus |
||||
Gardialamblacyster |
||||
guardia muristsi |
||||
Cryptosporidium |
||||
For 90 % inaktivering (1 logg) |
Det er klart at ozon er bedre enn desinfeksjonsmidler som klor, kloramin og klordioksid. For patogener som E-coli er ozon mer effektivt enn klor, men ikke mye. Samtidig, for kryptosporidium, nærmer forholdet mellom C og kriteriene for disse desinfeksjonsmidlene 1000. Det antas at i prinsippet kan slike desinfeksjonsmidler som klor, brom, jod, klordioksid og sølv konkurrere med ozon Molekylær gassformig klor , oppløses i vann, spaltes og produserer saltsyre HOCl, som igjen dissosieres i vann til anion SEO og kation H. Graden av denne dissosiasjonen bestemmes av surheten til mediet. Det er fastslått at ved pH = 8 er konsentrasjonen av ikke-dissosiert syre ≈ 20 %, og ved pH = 7 er konsentrasjonen av HClO ≈ 80 %. Siden det er HClO som har en sterk bakteriedrepende effekt, er det ved bruk av klor (selv i form av hypokloritt) nødvendig å opprettholde den optimale pH-verdien Jod, som desinfeksjonsmiddel, brukes til desinfeksjon i små vannbehandlingssystemer og noen ganger i små svømmebassenger. Når det gjelder desinfiserende egenskaper, er jod svakere enn klor, og enda mer ozon, men det er mer praktisk å transportere. Brom kan i prinsippet brukes til desinfeksjonsformål, men i nærvær av andre oksidasjonsmidler danner ballaster, derivater av HbrO3-syre, som er svært skadelige og de tilsvarer en lav MPC-verdi. Dette problemet - dannelsen av bromater under ozonering av bromholdig vann - er ganske alvorlig, og vi vil dvele ved det i avsnittet "Bruk av ozon til fremstilling av drikkevann." I tillegg har innenlandsk og utenlandsk industri nylig tilbudt en rekke organiske stoffer med sterk desinfiserende effekt. Alle har imidlertid visse ulemper og har ennå ikke blitt mye brukt.- Lenge ble det brukt flytende klor fra trykkflasker, noe som var et stort problem sett fra sikkerhetssynspunktet. For tiden oppnås klor i spesielle kloratapparater, ved elektrolyse av en natriumkloridløsning, eller hypokloritt brukes, som ved oppløsning i vann skaper den nødvendige konsentrasjonen av fritt klor. Det skal bemerkes at begrepet "fritt klor" refererer til konsentrasjonen av hypoklorsyre HClO. Bruk av kloreringsmidler gjør det nødvendig å lagre en tilførsel av reagens, og hypokloritt brytes ned under lagring og fritt klorinnhold synker.Ozon produseres på stedet og alt som trengs for produksjonen er en ozonator og elektrisitet. - Klor er en giftig gass (maksimal konsentrasjonsgrense for klor er 1 mg/m³). Det ble først brukt som et kjemisk krigføringsmiddel i første verdenskrig, og ofrene var mange. Ozon tilhører også kategorien giftige gasser og dens MPC er svært lav (0,1 mg/m³). Heldigvis har ozon en ekstremt sterk karakteristisk lukt, og en person føler tilstedeværelsen av ozon i luften mye tidligere enn konsentrasjonen når en farlig verdi (lukteterskel ≈ 0,1 / 0,5 MPC). Det må understrekes at det foreløpig ikke er rapportert noen dødelige eller til og med alvorlige tilfeller av ozonforgiftning som krever sykehusinnleggelse. Spørsmålet om ozontoksisitet vil bli vurdert separat nedenfor.En av de viktigste ubehagelige egenskapene til klor er at når det reagerer med de fleste organiske forbindelser, oppstår en hel rekke organoklorderivater, hvorav de fleste er svært giftige. Klorfenoler og polyklorfenoler, spesielt de såkalte dioksiner, er blant de sterkeste kjente organiske giftstoffene, og effekten av disse giftstoffene er å ødelegge menneskets immunsystem. Så når man snakker om dioksiner, brukes noen ganger begrepet "kjemisk AIDS" Klor interagerer veldig lett med ammoniakk og danner kloraminer. Disse stoffene har en svært svak desinfiserende effekt, men de er ekstremt irriterende for slimhinner i øyne og nesesvelg.Kloraminer kalles ofte «kombinert klor». Dette bundne kloret er 5-10 ganger sterkere irriterende enn fritt klor Ozon kan også danne mellomprodukter (biprodukter) under ozonering av gassformige og kondenserte medier. Teoretisk kan det antas at produktene som dannes av produkter er mer giftige enn ozon.Dette problemet har vært gjenstand for forskning av mange forskere rundt om i verden. Konsentrasjonene og sammensetningen av mellomproduktene som oppstår ved ozonering er svært avhengig av om drikkevann eller avløpsvann ozoneres. Selvfølgelig, i det første tilfellet, dannes mye mindre biprodukter og sammensetningen deres er mer åpenbar. Alle disse spørsmålene vil bli diskutert i de relevante delene av anmeldelsen. Vi kan oppsummere de ganske overlappende spørsmålene fra mange års forskning som følger:
- I de aller fleste tilfeller er mellomproduktene av ozonoksidasjon av forurensninger MINDRE GIFTIGE enn de originale ingrediensene.
- En direkte sammenligning av mellomproduktene dannet i sammenlignende forsøk på klorering og ozonering viste at det i det første tilfellet dannes mye mer biprodukter.
2.1. Desinfeksjon med klor og ozon ved industrielle renseanlegg og i laboratoriet.
Den langsiktige historien om bruk av disse 2 desinfeksjonsmidlene i store avløpsrenseanlegg inneholder et vell av faktamateriale som lar en bedømme fordelene og ulempene deres. Den allerede nevnte boken "Ozonation of Water" gir en rekke interessante eksempler, og under den langvarige driften av stasjonen i Nice ble bakteriene Escherichia coli og Clostridium pertringers aldri funnet i ozonisert vann.
Ved Belmont filtreringsstasjon i Philadelphia (USA) ga vannozonering mer vellykkede resultater i døden av e-coli enn resultatene oppnådd med klorering.Vannozoneringsstudier ble utført ved Eastern Waterworks i Moskva. Effekten av vanndesinfeksjon med ozon når det totale antallet bakterier i 1 ml er 800-1200 enheter. er: ved en ozondose på 1 ml/l - 60-65%, ved en dose på 2 ml/l - 85%, ved en dose på 3 ml/l - 90-95%. En akseptabel dose ozon bør vurderes 3-4 ml/l. Ozonering av vannet i Moskva-elven ble utført ved Rublevskaya vannverk (Moskva). Det totale antallet bakterier i 1 ml vann etter introduksjonen av ozon sank med 92-99 % i løpet av en tidsperiode på 1-25 minutter. Den bakteriedrepende dosen av ozon tilsvarte den etter behandling, som ikke kunne påvise e-coli i 500 ml. vann. En økning i turbiditet fra 6,8 til 12 mg / l og farge fra 3,2 til 18 grader. krevde en økning i den bakteriedrepende dosen av ozon fra 3,2 til 4,1 mg/l. Ridenor- og Ingalls-stasjonene fra USA behandlet suspensjoner av e-coli i destillert vann med klor og ozon ved Hp = 6,8 og ved en temperatur på 1 ºС. Under disse forholdene var de bakteriedrepende dosene som forårsaker døden til 99 % av e-coli-koloniene 0,25–0,3 mg/l i 16 minutter for klor og 0,5 mg/l i 1 min for ozon. Men klor og ozon gjør det ikke påvirker bakterier på nøyaktig samme måte. . Fra graf 2.3. man kan se at den bakterielle overlevelseskurven avtar med økende klordose, og det er en tilnærmet eksponentiell nedgang i antall bakterier. Ved ozonisering observeres et annet bilde - ved lave konsentrasjoner av ozon er effekten på bakterier ubetydelig, men fra en viss kritisk dose (0,3-0,5 mg / l) undertrykker ozon mikrofloraen kraftig og fullstendig, i motsetning til klor , som etterlater en ubetydelig del av dem uskadd. I følge noen studier krever den bakteriedrepende virkningen av ozon en viss tid. I dette tilfellet blir hele massen av bakterieprosent ozonisert. Klor produserer en selektiv forgiftning av de vitale sentrene til bakterier, og ganske sakte på grunn av behovet for lang tid for diffusjon i protoplasmaet.
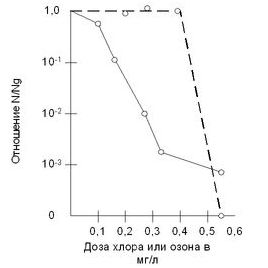
Graf over overlevelse av bakterier under vannbehandling med ozon og klor- - - - ozon-------- klor
2.4. Effekten av ozon på sporer, cyster og andre patogener.
I forhold til denne mikrofloraen fungerer ozon også som et effektivt bakteriell middel. Spesielt, ifølge Bringmann, ble Bacillus subtilis ødelagt i vann av ozon 3000 ganger raskere enn av klor. Kane og Glöckner studerte effekten av ozon og klor på cyster (harde skall som dannes rundt encellede organismer) av Endamoeba hystolica og på bakteriene som følger med disse kulturene. Det er fastslått at tiden som kreves for å ødelegge disse organismene ved en gjenværende ozonkonsentrasjon på 0,3 mg/l er 2-7,5 minutter, og for klor (restkonsentrasjon på 0,5-1 mg/l) er den mye lengre - 15 -20 minutter.
Effekten av ozon på virus
Ozon har en uttalt, radikal effekt på mange virus, som er ledsaget av den fullstendige fleksibiliteten til det virale proteinet. På 1940- og 1960-tallet gjennomførte virologer i USA og Tyskland en serie studier med suspensjoner av polioviruset for å inaktivere det med klor, ozon og klordioksid. Konklusjonene fra disse studiene kan oppsummeres som følger:
- Inaktivering av polioviruset med klor oppnås med en dose på 0,1 mg/l ved en vanntemperatur på 18 ºС; ved en vanntemperatur på 7 ºС bør dosen av klor være minst 0,25 mg/l.
- Virusinaktivering med ozon oppnås med en dose på 0,1 mg/l ved en vanntemperatur på 18 ºС, for kaldt vann -7 ºС bør dosen økes til 0,15 mg/l.
- Ved bruk av klordioksid skal det brukes en dose på 0,6 mg/l (18 ºC). For vann med en temperatur på 7 ºС bør dosen klordioksid være 1 mg/l.
Ifølge Naumann ødelegges årsakene til polio av ozon på 2 minutter ved en konsentrasjon på 0,45 mg/l, mens ved klorering ved en dose på 1 mg/l tar dette 3 timer.
Ozon og hydrobioner
Ifølge en rekke forfattere eliminerer ozon mikroalger og protozoer mer aktivt enn klor. Dermed ødelegger ozon ved en konsentrasjon på 15 mg/l på 3 minutter protozoarter som beholder sin aktivitet når vann behandles med en klordose på 250 mg/l i lang tid. Larver av muslingsebramuslingen døde med 90 % ved en ozondose på 0,9-1,0 mg/l, 98 % ved en dose på 2 mg/l, og fullstendig ved en dose på 3 mg/l. Voksne former av bløtdyr døde etter en lengre behandling med ozonisert vann (opptil 30 min). Riktignok er algeoppblomstring, som vanligvis trives i åpne bassenger i sollys, litt påvirket av ozon. Her brukes sjokkdoser av klor. Denne behandlingen utføres vanligvis om natten under den forebyggende rengjøringen av slike bassenger. Oppsummerer noen av den ekstremt korte sammenligningen av ozon, klor og klordioksid som et middel for rengjøring og desinfisering av vann, bemerker vi at denne tvisten i en viss forstand var løst av livet selv. Erfaringene fra vannbehandlingsanlegg som bruker ozon og klor, vitner faktisk til fordel for ozon. Ved å sammenligne arbeidet til den franske vannbehandlingsstasjonen i Saint-Maur og stasjonen i Chicago (USA), bemerker VF Kozhinov at i det første tilfellet ble sykdommer av "vannopprinnelse" registrert bare i 1 tilfelle per 100 tusen innbyggere, selv om konsentrasjonen av gjenværende ozon i vann ikke oversteg 0,05 mg/l. Samtidig var det utbrudd av gastrointestinale sykdommer i Chicago, til tross for det meget betydelige innholdet av klor i springvannet.En av forrige århundres største hygienikere, M. T. B. Whiteson, talte på den internasjonale kongressen om vannforsyning i Stockholm (juli). 1964) ) en slik uttalelse: "Den viktigste innvendingen mot ozonering regnes vanligvis som fravær av gjenværende ozon it, mens restklor kan påvises i nettet under klorering." Eksperimenter utført i Ashton (England) har vist at i ozon-desinfisert vann som sirkulerer i et brukbart vannrørledningsnett, blir kvaliteten ikke dårligere. Kontrollprøver av ozonholdig vann tatt fra nettet viste seg å være helt ekvivalent med prøver tatt fra andre kilder som inneholder restklor i vann Det ble også fastslått at en liten mengde restklor i rørledninger ikke kan ha noen desinfiserende effekt på forurensning forårsaket av skade på kommunikasjon. De. Tilstedeværelsen av gjenværende klor i rørledninger betyr ennå ikke den uunnværlige bakterielle renheten til vann, selv om det ofte anses som nettopp det. En av forfatterne av denne anmeldelsen diskuterte dette problemet med ledende arbeidere i Zürichs vannforsyning, og de bekreftet oppfatningen til M.T.B.-desinfeksjonsmidler, fordelene med ozon er udiskutable. På grunn av den korte anmeldelsen, dveler vi ikke her ved slike positive egenskaper til ozon som forsterkning av koagulasjons-flokkuleringsprosesser, den effektive gjennomføringen av mikroflokkuleringsprosessen, den uforlignelige høyere kvaliteten på vann i svømmebassenger som bruker ozon i stedet for klor, og en rekke andre. Til slutt er det spørsmålet om kostnadene. Det er en oppfatning at ozonering er mye dyrere enn klorering. Det er det imidlertid ikke. I prosessen med klorering blir det nødvendig å fjerne overflødig klor fra vannet, for å utføre den såkalte dekloreringen. For å oppnå vann av tilfredsstillende kvalitet, må dette gjøres med spesielle reagenser. Tatt i betraktning denne faktoren, samt trendene med en kontinuerlig nedgang i prisen på ozoneringsutstyr og en økning i prisen på klor og klorprodukter, er kostnadene for disse prosessene for tiden nesten sammenlignbare. Men klorering, hvis vi snakke om landet vårt, brukes oftere enn ozonering . Hvorfor? Det er flere grunner: - psykologisk grunn. Å jobbe med klor, spesielt når det kommer til flasker med flytende klor, er relativt enkelt. Det er nok å skru av ventilen til sylinderen eller helle en bøtte med hypokloritt i bassenget, da alle problemer med desinfeksjon er løst. Dette er absolutt enklere enn å overvåke konsentrasjonen av ozon som forlater ozonisatoren, gitt at ozonisatoren er en relativt kompleks enhet og du må være sikker på at den ikke plutselig slår seg av. - Det er her den andre (og kanskje den første) grunnen for den lave prevalensen oppstår ozon. Inntil helt nylig levde påliteligheten til ozonutstyr mye å være ønsket, og det lave automatiseringsnivået krevde bruk av relativt høyt kvalifisert servicepersonell. for å redusere kostnadene ved produksjon av høyspente pulsgeneratorer, utvikling av mikroprosessorteknologi og nye typer ultrafiolette sensorer, moderne syntetiske zeolitter, etc. Alt dette, så vel som resultatene av studier av pulserende elektriske utladninger i luft, gjorde det mulig å utvikle nye teknologiske løsninger som åpnet for helt nye muligheter for produksjon av tørrluftozonisatorer, oksygenozonisatorer, systemer for overvåking av gjenværende ozon i vann, ozonometre, oksygenkonsentratorer og annet utstyr som gjør bruken av ozonering til en mye enklere og mer praktisk teknologi enn den pleide å være. Vi er glade for at vår forskning og utvikling, beskyttet av patenter i Russland, USA, Japan og andre land, bidrar til å gjøre menneskers liv enklere, tryggere og forhåpentligvis lengre.
Bibliografi
Draginsky V.L., Alekseeva L.P., Samoylovich V.G. "Ozonering i vannrenseprosesser" M. Delhi print. 2007
Eng. V.V. Karaffa-Korbutt "Ozon og dets anvendelse i industri og sanitær" Ed. "Utdanning" SpP. 1912
V.F. Kozhinov, I.V. Kozhinov "Ozonering av vann" M. Stroyizdat 1973
V.V. Lukin, M.P. Popovich, S.N. Tkachenko "Ozonets fysiske kjemi" Ed. Moskva statsuniversitet 1998
Manley T.S., Negowski S.J. "Ozon" i Encyclopedic of Chemical Technology. Andre utgave. Vol. 14. N.J. 1967.
Hozvath M.H., Bilitrki, haud., Huttez. "Ozon" Ed. Akademi. Kiado. Budapest 1987
Kogan B.F. og br. "Håndbok for løselighet" v.1, bok. 1, M. 1961.
Masschelein W.J. "Processer unitaixes du treatmeut de l esu drinkable" Ed. CEBEIOC. hiege. 1996.
Jore M., hegube B.J. Er. Hydrol. 14.11.1983.
Cowen W Foster. Kjemi i gjenbruk av vann. Ed. Ann. Azboz. Science Publ. Michigan. 1985.
Curol M.D. Env. Prog. 4.46.1985.
Hoigne J. "In Progress Technologies for vannbehandling" Ed. Plenum. Trykk nr. 3. 1988
Rozumovsky S.D. og Zaikov G.Z. "Ozon og dets reaksjoner med organiske forbindelser" M. 1974.
Hubner R. Gesundheitstechnik nr. 12. 1973.
Dojbido J. Etol. "Danning av mellomprodukter i prosessen med ozonering og klorering" Wat. Res. 1999. 33. nr. 4 s3111 - 3118.
Ridenour G.M., Inglols R.S. "American Journal of Public Health" 1946. 3.6p 639.
Gomella C. 2e behandling d eux par l ozon. "Extract du mensuel" du ceutre Belge 287. 1967.
Kozhinov V.F. Vann ozonering. "Moskva byøkonomi" 1970. nr. 7.
Steinhardt. Stadtehygiene. 1S. 1956.
Naumman E. "Das gas nnd Wassertach" 1952. NY.s.81.
Dickerman J.M. etral. Journ of New England Water Works Ass. 1.11.1954.
Shalashova E.S. «Bruk av ozon til vannrensing av boliger og fellestjenester» nr. 6. 1960.
Thorp C.E. Jnd. Med og Surg. 1950. v19 s 49
M.U. 2.1.2.694-98. "Bruk av ultrafiolett måling ved desinfeksjon av vann i svømmebassenger".
G.I. Rogozhkin. "Rensing og desinfeksjon av vann i bassenger" VVS. 4.2003. s. 4-9.
OZON (O 3) er en allotrop modifikasjon av oksygen, dets molekyl består av tre oksygenatomer og kan eksistere i alle tre aggregeringstilstander. Ozonmolekylet har en vinkelstruktur i form av en likebenet trekant med et toppunkt på 127 o . Det dannes imidlertid ikke en lukket trekant, og molekylet har en kjedestruktur på 3 oksygenatomer med en avstand mellom dem på 0,224 nm. I følge denne molekylstrukturen er dipolmomentet 0,55 debye. I den elektroniske strukturen til ozonmolekylet er det 18 elektroner som danner et mesomerisk stabilt system som eksisterer i ulike grensetilstander. De ioniske grensestrukturene gjenspeiler dipol-naturen til ozonmolekylet og forklarer dets spesifikke reaksjonsoppførsel sammenlignet med oksygen, som danner et radikal med to uparrede elektroner. Ozonmolekylet består av tre oksygenatomer. Den kjemiske formelen til denne gassen er O 3 Ozondannelsesreaksjon: 3O 2 + 68 kcal / mol (285 kJ / mol) ⇄ 2O 3 Ozonmolekylvekt - 48 Ved romtemperatur er ozon en fargeløs gass med en karakteristisk lukt. Lukten av ozon kjennes ved en konsentrasjon på 10 -7 M. I flytende tilstand er ozon en mørkeblå farge med et smeltepunkt på -192,50 C. Fast ozon er svarte krystaller med et kokepunkt på -111,9 grader C. Ved en temperatur på 0 gr. og 1 atm. = 101,3 kPa ozontetthet er 2,143 g/l. I gassform er ozon diamagnetisk og presses ut av magnetfeltet, i flytende tilstand er det svakt paramagnetisk, dvs. har sitt eget magnetfelt og trekkes inn i magnetfeltet.
Kjemiske egenskaper til ozon
Ozonmolekylet er ustabilt og ved tilstrekkelige konsentrasjoner i luften under normale forhold, blir det spontant til diatomisk oksygen ved frigjøring av varme. En økning i temperatur og en reduksjon i trykk øker hastigheten på ozonnedbrytningen. Kontakten av ozon med selv små mengder organiske stoffer, noen metaller eller deres oksider, fremskynder transformasjonen kraftig. Den kjemiske aktiviteten til ozon er veldig høy, det er et kraftig oksidasjonsmiddel. Det oksiderer nesten alle metaller (med unntak av gull, platina og iridium) og mange ikke-metaller. Reaksjonsproduktet er hovedsakelig oksygen. Ozon løses opp i vann bedre enn oksygen, og danner ustabile løsninger, og nedbrytningshastigheten i løsningen er 5-8 ganger høyere enn i gassfasen enn i gassfasen (Razumovsky SD, 1990). Dette skyldes tilsynelatende ikke spesifikasjonene til den kondenserte fasen, men dens reaksjoner med urenheter og hydroksylionet, siden nedbrytningshastigheten er veldig følsom for innholdet av urenheter og pH. Løseligheten av ozon i natriumkloridløsninger følger Henrys lov. Med en økning i konsentrasjonen av NaCl i en vandig løsning, avtar løseligheten av ozon (Tarunina VN et al., 1983). Ozon har en meget høy elektronaffinitet (1,9 eV), som bestemmer dens egenskaper som et sterkt oksidasjonsmiddel, kun overgått av fluor (Razumovsky SD, 1990).Biologiske egenskaper av ozon og dets effekt på menneskekroppen
Den høye oksidasjonsevnen og det faktum at frie oksygenradikaler dannes i mange kjemiske reaksjoner som skjer med deltakelse av ozon, gjør denne gassen ekstremt farlig for mennesker. Hvordan påvirker ozongass mennesker:- Irriterer og skader luftveiene;
- Påvirker kolesterol i menneskelig blod, danner uløselige former, noe som fører til aterosklerose;
- Et langt opphold i et miljø med høy konsentrasjon av ozon kan forårsake mannlig infertilitet.
- Maksimal enkelt maksimal tillatt konsentrasjon (MAC m.r.) i den atmosfæriske luften i befolkede områder 0,16 mg / m 3
- Gjennomsnittlig daglig maksimal tillatt konsentrasjon (MPC d.s.) - 0,03 mg/m 3
- Den maksimalt tillatte konsentrasjonen (MAC) i luften i arbeidsområdet er 0,1 mg/m 3 (samtidig er terskelen for menneskelig luktesans omtrent lik 0,01 mg/m 3).
Skadelige og gunstige egenskaper av ozon
Ozon finnes i to lag av atmosfæren. Troposfærisk eller bakkenivå ozon, som ligger i laget av atmosfæren nærmest jordoverflaten - i troposfæren - er farlig. Det er skadelig for mennesker og andre levende organismer. Det har en skadelig effekt på trær, avlinger. I tillegg er troposfærisk ozon en av de viktigste "ingrediensene" i urban smog. Samtidig er stratosfærisk ozon veldig nyttig. Ødeleggelsen av ozonlaget som dannes av det (ozonskjermen) fører til at strømmen av ultrafiolett stråling til jordens overflate øker. På grunn av dette øker antallet hudkreft (inkludert den farligste typen, melanom), og tilfeller av grå stær. Eksponering for hardt ultrafiolett svekker immunforsvaret. Overdreven UV-stråling kan også være et problem for landbruket, siden noen avlinger er ekstremt følsomme for UV-lys. Samtidig bør det huskes at ozon er en giftig gass, og på nivå med jordoverflaten er det en skadelig forurensning. Om sommeren, på grunn av intens solstråling og varme, dannes det spesielt mye skadelig ozon i luften.Samspill mellom ozon og oksygen med hverandre. Likheter og ulikheter.
Ozon er en allotropisk form for oksygen. Allotropi er eksistensen av det samme kjemiske elementet i form av to eller flere enkle stoffer. I dette tilfellet dannes både ozon (O3) og oksygen (O 2) av det kjemiske elementet O. Å få ozon fra oksygen Som regel fungerer molekylært oksygen (O 2) som utgangsmateriale for å oppnå ozon, og selve prosessen er beskrevet av ligningen 3O 2 → 2O 3. Denne reaksjonen er endoterm og lett reversibel. For å flytte likevekten mot målproduktet (ozon), brukes visse tiltak. En måte å produsere ozon på er å bruke en lysbueutslipp. Den termiske dissosiasjonen av molekyler øker kraftig med økende temperatur. Således, ved T=3000K, er innholdet av atomært oksygen ~10%. En temperatur på flere tusen grader kan oppnås ved å bruke en lysbueutladning. Men ved høye temperaturer brytes ozon ned raskere enn molekylært oksygen. For å forhindre dette kan likevekten forskyves ved først å varme opp gassen og deretter bråkjøle den. Ozon er i dette tilfellet et mellomprodukt under overgangen av en blanding av O 2 + O til molekylært oksygen. Den maksimale konsentrasjonen av O 3 som kan oppnås med denne produksjonsmetoden når 1%. Dette er tilstrekkelig for de fleste industrielle formål. Oksiderende egenskaper til ozon Ozon er et kraftig oksidasjonsmiddel, mye mer reaktivt enn diatomisk oksygen. Oksiderer nesten alle metaller og mange ikke-metaller med dannelse av oksygen: 2 Cu 2+ (aq) + 2 H 3 O + (aq) + O 3 (g) → 2 Cu 3+ (aq) + 3 H 2 O (1) + O 2 (g) Ozon kan delta i forbrenningsreaksjoner, forbrenningstemperaturen er høyere enn ved brenning i en atmosfære av diatomisk oksygen: 3 C 4 N 2 + 4 O 3 → 12 CO + 3 N 2 Standard ozon potensialet er 2,07 V, derfor er ozonmolekylet ustabilt og blir spontant til oksygen med frigjøring av varme. Ved lave konsentrasjoner brytes ozon sakte ned, ved høye konsentrasjoner - med en eksplosjon, pga molekylet har overskuddsenergi. Oppvarming og kontakt av ozon med ubetydelige mengder organiske stoffer (hydroksider, peroksider, metaller med variabel valens, deres oksider) akselererer transformasjonen kraftig. Tvert imot stabiliserer tilstedeværelsen av små mengder salpetersyre ozon, og i kar laget av glass og noen plast eller rene metaller brytes ozon praktisk talt ned ved -78 0 C. Affiniteten til ozon for et elektron er 2 eV. Bare fluor og dets oksider har en så sterk affinitet. Ozon oksiderer alle metaller (med unntak av gull og platina), samt de fleste andre grunnstoffer. Klor reagerer med ozon og danner hypoklor OCL. Reaksjonene mellom ozon og atomært hydrogen er kilden til dannelsen av hydroksylradikaler. Ozon har et absorpsjonsmaksimum i UV-området ved en bølgelengde på 253,7 nm med en molar ekstinksjonskoeffisient: E = 2.900 Basert på dette er UV-fotometrisk bestemmelse av ozonkonsentrasjon sammen med jodometrisk titrering akseptert som internasjonale standarder. Oksygen, i motsetning til ozon, reagerer ikke med KI.Løselighet av ozon og dets stabilitet i vandige løsninger
Hastigheten for ozonnedbrytning i løsning er 5-8 ganger høyere enn i gassfasen. Løseligheten av ozon i vann er 10 ganger høyere enn for oksygen. Ifølge forskjellige forfattere varierer løselighetskoeffisienten til ozon i vann fra 0,49 til 0,64 ml ozon/ml vann. Under ideelle termodynamiske forhold adlyder likevekten Henrys lov, dvs. konsentrasjonen av en mettet gassløsning er proporsjonal med partialtrykket. C S = B × d × Рi hvor: С S er konsentrasjonen av en mettet løsning i vann; d er massen av ozon; Pi er partialtrykket til ozon; B er oppløsningskoeffisienten; Oppfyllelsen av Henrys lov for ozon som en metastabil gass er betinget. Nedbrytningen av ozon i gassfasen avhenger av partialtrykket. I vannmiljøet foregår det prosesser som går utenfor Henrys lov. I stedet, under ideelle forhold, gjelder Gibs-Dukem-Margulesdu-loven. I praksis er det vanlig å uttrykke løseligheten av ozon i vann i forhold til forholdet mellom ozonkonsentrasjonen i et flytende medium og ozonkonsentrasjonen i gassfasen: Ozonmetningen avhenger av temperatur og vannkvalitet, siden organiske og uorganiske urenheter endres mediets pH. Under samme forhold i springvann er konsentrasjonen av ozon 13 mg/l, i dobbeltdestillert vann - 20 mg/l. Årsaken til dette er den betydelige nedbrytningen av ozon på grunn av ulike ioniske urenheter i drikkevann.Ozonnedbrytning og halveringstid (t 1/2)
I vannmiljøet avhenger ozonnedbrytningen sterkt av vannkvalitet, temperatur og pH i miljøet. En økning i pH i mediet akselererer nedbrytningen av ozon og reduserer samtidig konsentrasjonen av ozon i vann. Lignende prosesser skjer med økende temperatur. Halveringstiden til ozon i dobbeltdestillert vann er 10 timer, i demineralisert vann - 80 minutter; i destillert vann - 120 minutter. Det er kjent at nedbrytning av ozon i vann er en kompleks prosess med reaksjoner av radikale kjeder: Maksimal mengde ozon i vannprøven observeres innen 8-15 minutter. Etter 1 time observeres kun frie oksygenradikaler i løsningen. Blant dem er den viktigste hydroksylradikalet (OH') (Staehelin G., 1985), og dette må tas i betraktning ved bruk av ozonisert vann til terapeutiske formål. Siden ozonisert vann og ozonisert saltvann brukes i klinisk praksis, evaluerte vi disse ozoniserte væskene avhengig av konsentrasjonene som brukes i husholdningsmedisin. De viktigste analysemetodene var jodometrisk titrering og intensiteten av kjemiluminescens ved bruk av en biokjemiluminometeranordning BKhL-06 (produsert av Nizhny Novgorod) (Kontorshchikova K.N., Peretyagin S.P., Ivanova I.P. 1995). Fenomenet kjemiluminescens er assosiert med rekombinasjonsreaksjoner av frie radikaler dannet under nedbrytningen av ozon i vann. Ved behandling av 500 ml bi- eller destillert vann ved å boble med en ozon-oksygengassblanding med en ozonkonsentrasjon i området 1000-1500 μg/l og en gassstrømhastighet på 1 l/min i 20 minutter, oppdages kjemiluminescens innen 160 minutter. Dessuten, i dobbeltdestillert vann, er luminescensintensiteten betydelig høyere enn i destillert vann, noe som forklares av tilstedeværelsen av urenheter som slukker luminescensen. Løseligheten av ozon i NaCl-løsninger følger Henrys lov, dvs. avtar med økende saltkonsentrasjon. Den fysiologiske løsningen ble behandlet med ozon i en konsentrasjon på 400, 800 og 1000 μg/l i 15 minutter. Den totale glødeintensiteten (i mv) økte med økende ozonkonsentrasjon. Glødevarigheten er 20 minutter. Dette er på grunn av den raskere rekombinasjonen av frie radikaler og derav slukking av gløden på grunn av tilstedeværelsen av urenheter i den fysiologiske løsningen. Til tross for det høye oksidasjonspotensialet har ozon en høy selektivitet, noe som skyldes molekylets polare struktur. Forbindelser som inneholder frie dobbeltbindinger (-C=C-) reagerer øyeblikkelig med ozon. Som et resultat er umettede fettsyrer, aromatiske aminosyrer og peptider, spesielt de som inneholder SH-grupper, følsomme for ozon. I følge Krige (1953) (sitert fra Vieban R. 1994) er det primære produktet av interaksjonen mellom ozonmolekylet og bioorganiske substrater et 1-3 dipolart molekyl. Denne reaksjonen er den viktigste i samspillet mellom ozon og organiske substrater ved pH< 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
Maksimal mengde ozon i vannprøven observeres innen 8-15 minutter. Etter 1 time observeres kun frie oksygenradikaler i løsningen. Blant dem er den viktigste hydroksylradikalet (OH') (Staehelin G., 1985), og dette må tas i betraktning ved bruk av ozonisert vann til terapeutiske formål. Siden ozonisert vann og ozonisert saltvann brukes i klinisk praksis, evaluerte vi disse ozoniserte væskene avhengig av konsentrasjonene som brukes i husholdningsmedisin. De viktigste analysemetodene var jodometrisk titrering og intensiteten av kjemiluminescens ved bruk av en biokjemiluminometeranordning BKhL-06 (produsert av Nizhny Novgorod) (Kontorshchikova K.N., Peretyagin S.P., Ivanova I.P. 1995). Fenomenet kjemiluminescens er assosiert med rekombinasjonsreaksjoner av frie radikaler dannet under nedbrytningen av ozon i vann. Ved behandling av 500 ml bi- eller destillert vann ved å boble med en ozon-oksygengassblanding med en ozonkonsentrasjon i området 1000-1500 μg/l og en gassstrømhastighet på 1 l/min i 20 minutter, oppdages kjemiluminescens innen 160 minutter. Dessuten, i dobbeltdestillert vann, er luminescensintensiteten betydelig høyere enn i destillert vann, noe som forklares av tilstedeværelsen av urenheter som slukker luminescensen. Løseligheten av ozon i NaCl-løsninger følger Henrys lov, dvs. avtar med økende saltkonsentrasjon. Den fysiologiske løsningen ble behandlet med ozon i en konsentrasjon på 400, 800 og 1000 μg/l i 15 minutter. Den totale glødeintensiteten (i mv) økte med økende ozonkonsentrasjon. Glødevarigheten er 20 minutter. Dette er på grunn av den raskere rekombinasjonen av frie radikaler og derav slukking av gløden på grunn av tilstedeværelsen av urenheter i den fysiologiske løsningen. Til tross for det høye oksidasjonspotensialet har ozon en høy selektivitet, noe som skyldes molekylets polare struktur. Forbindelser som inneholder frie dobbeltbindinger (-C=C-) reagerer øyeblikkelig med ozon. Som et resultat er umettede fettsyrer, aromatiske aminosyrer og peptider, spesielt de som inneholder SH-grupper, følsomme for ozon. I følge Krige (1953) (sitert fra Vieban R. 1994) er det primære produktet av interaksjonen mellom ozonmolekylet og bioorganiske substrater et 1-3 dipolart molekyl. Denne reaksjonen er den viktigste i samspillet mellom ozon og organiske substrater ved pH< 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
 Ozonering av aromatiske forbindelser fortsetter med dannelsen av polymere ozonider. Tilsetningen av ozon bryter den aromatiske konjugasjonen i kjernen og krever energi, så ozoneringshastigheten til homologer korrelerer med konjugasjonsenergien. Ozoneringen av tørkede hydrokarboner er assosiert med innføringsmekanismen. Ozonering av svovel- og nitrogenholdige organiske forbindelser foregår som følger:
Ozonering av aromatiske forbindelser fortsetter med dannelsen av polymere ozonider. Tilsetningen av ozon bryter den aromatiske konjugasjonen i kjernen og krever energi, så ozoneringshastigheten til homologer korrelerer med konjugasjonsenergien. Ozoneringen av tørkede hydrokarboner er assosiert med innføringsmekanismen. Ozonering av svovel- og nitrogenholdige organiske forbindelser foregår som følger:  Ozonider er vanligvis dårlig løselige i vann, men gode i organiske løsemidler. Ved oppvarming brytes virkningen av overgangsmetaller ned til radikaler. Mengden av ozonider i en organisk forbindelse bestemmes av jodtallet. Jodtallet er massen av jod i gram tilsatt 100 g organisk materiale. Normalt, for fettsyrer, er jodtallet 100-400, for fast fett 35-85, for flytende fett - 150-200. For første gang ble ozon som antiseptisk middel testet av A. Wolff tilbake i 1915 under første verdenskrig. I løpet av de påfølgende årene akkumulerte gradvis informasjon om vellykket bruk av ozon i behandlingen av ulike sykdommer. Imidlertid ble det i lang tid bare brukt ozonterapimetoder, assosiert med direkte kontakter av ozon med ytre overflater og forskjellige kroppshulrom. Interessen for ozonterapi økte med akkumulering av data om den biologiske effekten av ozon på kroppen og fremveksten av rapporter fra ulike klinikker rundt om i verden om vellykket bruk av ozon i behandlingen av en rekke sykdommer. Historien om medisinsk bruk av ozon begynner på 1800-tallet. Pionerene innen klinisk bruk av ozon var vestlige forskere i Amerika og Europa, spesielt C. J. Kenworthy, B. Lust, I. Aberhart, E. Payer, E. A. Fisch, N. N. Wolff og andre. Lite var kjent om den terapeutiske bruken av ozon i Russland. Først på 60-70-tallet dukket flere arbeider om inhalasjonsozonterapi og om bruk av ozon i behandlingen av visse hudsykdommer opp i den innenlandske litteraturen, og siden 80-tallet i vårt land har denne metoden blitt intensivt utviklet og mer utbredt. Grunnlaget for den grunnleggende utviklingen av ozonterapiteknologier ble i stor grad bestemt av arbeidet til Institute of Chemical Physics ved USSR Academy of Medical Sciences. Boken "Ozon og dets reaksjoner med organiske stoffer" (S. D. Razumovsky, G. E. Zaikov, Moskva, 1974) var utgangspunktet for å underbygge mekanismene for den terapeutiske effekten av ozon av mange utviklere. International Ozone Association (IOA), som har holdt 20 internasjonale kongresser, er vidt aktiv i verden, og siden 1991 har våre leger og forskere også deltatt på disse kongressene. I dag vurderes problemene med anvendt bruk av ozon, nemlig i medisin, på en helt ny måte. I det terapeutiske området av konsentrasjoner og doser, utviser ozon egenskapene til en kraftig bioregulator, et middel som i stor grad kan forbedre metodene for tradisjonell medisin, og ofte fungerer som et monoterapimiddel. Bruk av medisinsk ozon er en kvalitativt ny løsning på presserende problemer i behandlingen av mange sykdommer. Ozonterapiteknologier brukes innen kirurgi, obstetrikk og gynekologi, odontologi, nevrologi, terapeutisk patologi, infeksjonssykdommer, dermatologi og kjønnssykdommer og en rekke andre sykdommer. Ozonterapi er preget av enkel utførelse, høy effektivitet, god toleranse, praktisk fravær av bivirkninger, og den er kostnadseffektiv. De terapeutiske egenskapene til ozon i sykdommer med ulike etiologier er basert på dens unike evne til å påvirke kroppen. Ozon i terapeutiske doser virker som et immunmodulerende, anti-inflammatorisk, bakteriedrepende, antiviralt, soppdrepende, cytostatisk, anti-stress og smertestillende middel. Dens evne til aktivt å korrigere forstyrret oksygenhomeostase i kroppen åpner store muligheter for gjenopprettende medisin. Et bredt spekter av metodiske muligheter gjør det mulig å bruke ozonets helbredende egenskaper med stor effektivitet for lokal og systemisk terapi. I de siste tiårene har metoder assosiert med parenteral (intravenøs, intramuskulær, intraartikulær, subkutan) administrering av terapeutiske doser av ozon kommet i forgrunnen, hvis terapeutiske effekt hovedsakelig er assosiert med aktivering av ulike vitale systemer i kroppen. Oksygen-ozon-gassblanding ved høye (4000 - 8000 µg/l) ozonkonsentrasjoner i den er effektiv i behandlingen av sterkt infiserte, dårlig helende sår, koldbrann, liggesår, brannskader, sopphudskader, etc. Ozon i høye konsentrasjoner kan også brukes som et hemostatisk middel. Lave konsentrasjoner av ozon stimulerer reparasjon, fremmer epitelisering og helbredelse. Ved behandling av kolitt, proktitt, fistler og en rekke andre tarmsykdommer brukes rektal administrering av en oksygen-ozongassblanding. Ozon oppløst i saltvann brukes med hell ved bukhinnebetennelse for sanering av bukhulen, og ozonisert destillert vann ved kjevekirurgi osv. Ozon oppløst i saltvann eller i pasientens blod brukes til intravenøs administrering. Europaskolens pionerer postulerte det hovedmålet med ozonterapi er: "Stimulering og reaktivering av oksygenmetabolisme uten å forstyrre redokssystemene" - dette betyr at når man beregner doser for en økt eller et kurs, bør den terapeutiske ozoneffekten være innenfor grensene der radikale oksygenmetabolitter eller overflødig peroksid er enzymatisk justert. (Z Rilling, R. Fiban 1996 i bok. Praksisen med ozonterapi). I utenlandsk medisinsk praksis, for parenteral administrering av ozon, brukes hovedsakelig stor og liten autohemoterapi. Når du utfører en stor autohemoterapi, blandes blodet som tas fra pasienten grundig med et visst volum oksygen-ozongassblanding, og dryppet injiseres umiddelbart tilbake i venen til samme pasient. Med en liten autohemoterapi injiseres ozonisert blod intramuskulært. Den terapeutiske dosen av ozon i dette tilfellet opprettholdes på grunn av faste volumer av gass og ozonkonsentrasjon i den.
Ozonider er vanligvis dårlig løselige i vann, men gode i organiske løsemidler. Ved oppvarming brytes virkningen av overgangsmetaller ned til radikaler. Mengden av ozonider i en organisk forbindelse bestemmes av jodtallet. Jodtallet er massen av jod i gram tilsatt 100 g organisk materiale. Normalt, for fettsyrer, er jodtallet 100-400, for fast fett 35-85, for flytende fett - 150-200. For første gang ble ozon som antiseptisk middel testet av A. Wolff tilbake i 1915 under første verdenskrig. I løpet av de påfølgende årene akkumulerte gradvis informasjon om vellykket bruk av ozon i behandlingen av ulike sykdommer. Imidlertid ble det i lang tid bare brukt ozonterapimetoder, assosiert med direkte kontakter av ozon med ytre overflater og forskjellige kroppshulrom. Interessen for ozonterapi økte med akkumulering av data om den biologiske effekten av ozon på kroppen og fremveksten av rapporter fra ulike klinikker rundt om i verden om vellykket bruk av ozon i behandlingen av en rekke sykdommer. Historien om medisinsk bruk av ozon begynner på 1800-tallet. Pionerene innen klinisk bruk av ozon var vestlige forskere i Amerika og Europa, spesielt C. J. Kenworthy, B. Lust, I. Aberhart, E. Payer, E. A. Fisch, N. N. Wolff og andre. Lite var kjent om den terapeutiske bruken av ozon i Russland. Først på 60-70-tallet dukket flere arbeider om inhalasjonsozonterapi og om bruk av ozon i behandlingen av visse hudsykdommer opp i den innenlandske litteraturen, og siden 80-tallet i vårt land har denne metoden blitt intensivt utviklet og mer utbredt. Grunnlaget for den grunnleggende utviklingen av ozonterapiteknologier ble i stor grad bestemt av arbeidet til Institute of Chemical Physics ved USSR Academy of Medical Sciences. Boken "Ozon og dets reaksjoner med organiske stoffer" (S. D. Razumovsky, G. E. Zaikov, Moskva, 1974) var utgangspunktet for å underbygge mekanismene for den terapeutiske effekten av ozon av mange utviklere. International Ozone Association (IOA), som har holdt 20 internasjonale kongresser, er vidt aktiv i verden, og siden 1991 har våre leger og forskere også deltatt på disse kongressene. I dag vurderes problemene med anvendt bruk av ozon, nemlig i medisin, på en helt ny måte. I det terapeutiske området av konsentrasjoner og doser, utviser ozon egenskapene til en kraftig bioregulator, et middel som i stor grad kan forbedre metodene for tradisjonell medisin, og ofte fungerer som et monoterapimiddel. Bruk av medisinsk ozon er en kvalitativt ny løsning på presserende problemer i behandlingen av mange sykdommer. Ozonterapiteknologier brukes innen kirurgi, obstetrikk og gynekologi, odontologi, nevrologi, terapeutisk patologi, infeksjonssykdommer, dermatologi og kjønnssykdommer og en rekke andre sykdommer. Ozonterapi er preget av enkel utførelse, høy effektivitet, god toleranse, praktisk fravær av bivirkninger, og den er kostnadseffektiv. De terapeutiske egenskapene til ozon i sykdommer med ulike etiologier er basert på dens unike evne til å påvirke kroppen. Ozon i terapeutiske doser virker som et immunmodulerende, anti-inflammatorisk, bakteriedrepende, antiviralt, soppdrepende, cytostatisk, anti-stress og smertestillende middel. Dens evne til aktivt å korrigere forstyrret oksygenhomeostase i kroppen åpner store muligheter for gjenopprettende medisin. Et bredt spekter av metodiske muligheter gjør det mulig å bruke ozonets helbredende egenskaper med stor effektivitet for lokal og systemisk terapi. I de siste tiårene har metoder assosiert med parenteral (intravenøs, intramuskulær, intraartikulær, subkutan) administrering av terapeutiske doser av ozon kommet i forgrunnen, hvis terapeutiske effekt hovedsakelig er assosiert med aktivering av ulike vitale systemer i kroppen. Oksygen-ozon-gassblanding ved høye (4000 - 8000 µg/l) ozonkonsentrasjoner i den er effektiv i behandlingen av sterkt infiserte, dårlig helende sår, koldbrann, liggesår, brannskader, sopphudskader, etc. Ozon i høye konsentrasjoner kan også brukes som et hemostatisk middel. Lave konsentrasjoner av ozon stimulerer reparasjon, fremmer epitelisering og helbredelse. Ved behandling av kolitt, proktitt, fistler og en rekke andre tarmsykdommer brukes rektal administrering av en oksygen-ozongassblanding. Ozon oppløst i saltvann brukes med hell ved bukhinnebetennelse for sanering av bukhulen, og ozonisert destillert vann ved kjevekirurgi osv. Ozon oppløst i saltvann eller i pasientens blod brukes til intravenøs administrering. Europaskolens pionerer postulerte det hovedmålet med ozonterapi er: "Stimulering og reaktivering av oksygenmetabolisme uten å forstyrre redokssystemene" - dette betyr at når man beregner doser for en økt eller et kurs, bør den terapeutiske ozoneffekten være innenfor grensene der radikale oksygenmetabolitter eller overflødig peroksid er enzymatisk justert. (Z Rilling, R. Fiban 1996 i bok. Praksisen med ozonterapi). I utenlandsk medisinsk praksis, for parenteral administrering av ozon, brukes hovedsakelig stor og liten autohemoterapi. Når du utfører en stor autohemoterapi, blandes blodet som tas fra pasienten grundig med et visst volum oksygen-ozongassblanding, og dryppet injiseres umiddelbart tilbake i venen til samme pasient. Med en liten autohemoterapi injiseres ozonisert blod intramuskulært. Den terapeutiske dosen av ozon i dette tilfellet opprettholdes på grunn av faste volumer av gass og ozonkonsentrasjon i den. Vitenskapelige prestasjoner fra innenlandske forskere begynte å bli regelmessig rapportert på internasjonale kongresser og symposier
- 1991 - Cuba, Havana,
- 1993 - USA San Francisco,
- 1995 - Frankrike Lille,
- 1997 - Japan, Kyoto,
- 1998 - Østerrike, Salzburg,
- 1999 – Tyskland, Baden-Baden,
- 2001 - England, London,
- 2005 - Frankrike, Strasbourg,
- 2009 - Japan, Kyoto,
- 2010 - Spania, Madrid
- 2011 Tyrkia (Istanbul), Frankrike (Paris), Mexico (Cancun)
- 2012 - Spania Madrid
All-russiske vitenskapelige og praktiske konferanser med internasjonal deltakelse om ozonterapi
I - "OZON I BIOLOGI OG MEDISIN" - 1992., N.Novgorod II - "OZON I BIOLOGI OG MEDISIN" - 1995., N.Novgorod III - "OZON OG METODER FOR EFERENT TERAPI" - 1998., N.Novgorod IV - "OZON OG METODER FOR EFERENT TERAPI" - 2000., N.Novgorod V - "OZON I BIOLOGI OG MEDISIN" - 2003., N.Novgorod VI - "OZON I BIOLOGI OG MEDISIN" - 2005., N.Novgorod"I-konferanse om ozonterapi av den asiatisk-europeiske union av ozonterapeuter og produsenter av medisinsk utstyr"- 2006., Bolshoe Boldino, Nizhny Novgorod-regionen VII - "OZON I BIOLOGI OG MEDISIN" - 2007., N.Novgorod U111 – "Ozon, reaktive oksygenarter og metoder for intensivbehandling i medisin" - 2009, Nizhny Novgorod I 2000 dannet den russiske skolen for ozonterapi endelig sin egen, forskjellig fra den europeiske, tilnærmingen til bruken av ozon som et terapeutisk middel. Hovedforskjellene er den utbredte bruken av fysiologisk saltvann som ozonbærer, bruken av betydelig lavere konsentrasjoner og doser av ozon, de utviklede teknologiene for ekstrakorporal behandling av store mengder blod (ozonisert kardiopulmonal bypass), individuelt valg av doser og konsentrasjoner av ozon i systemisk ozonterapi. Ønsket til flertallet av russiske leger om å bruke de laveste effektive konsentrasjonene av ozon gjenspeiler det grunnleggende prinsippet for medisin - "gjør ingen skade." Sikkerheten og effektiviteten til russiske metoder for ozonterapi har gjentatte ganger blitt dokumentert og bevist i forhold til ulike medisinske felt. Som et resultat av mange års grunnleggende klinisk forskning, etablerte forskere fra Nizhny Novgorod en ukjent regelmessighet i dannelsen av adaptive mekanismer i kroppen til pattedyr under systemisk eksponering for lave terapeutiske doser av ozon, som består i det faktum at utløseren er effekten av ozon på pro- og antioksidantbalansen i kroppen og skyldes en moderat intensivering av frie radikaler, som igjen øker aktiviteten til de enzymatiske og ikke-enzymatiske komponentene i antioksidantforsvarssystemet. ”(Kontorshchikova K.N., Peretyagin S.P.), som forfatterne mottok et funn for (diplom nr. 309 datert 16. mai 2006). I verkene til innenlandske forskere har nye teknologier og aspekter ved bruk av ozon til terapeutiske formål blitt utviklet:- Utbredt bruk av saltvannsløsning (0,9 % NaCl-løsning) som bærer av oppløst ozon
- Bruk av relativt lave konsentrasjoner og doser av ozon for systemisk eksponering (intravaskulær og intra-intestinal administrering)
- Intraossøse infusjoner av ozoniserte løsninger
- Intrakoronar administrering av ozoniserte kardioplegiløsninger
- Total ekstrakorporeal ozonbehandling av store mengder blod under kardiopulmonal bypass
- Lavstrøms ozonterapi
- Intraportal administrasjon av ozoniserte løsninger
- Bruken av ozon i operasjonsteatret
- Ledsagende systemisk ozonterapi med biokjemiske kontrollmetoder
- Ozonterapi er en ikke-medikamentell metode for terapeutisk effekt som gjør det mulig å oppnå positive resultater i patologi av forskjellig opprinnelse.
- Den biologiske effekten av parenteralt administrert ozon manifesteres på nivået av lave konsentrasjoner og doser, som er ledsaget av klinisk uttalte positive terapeutiske effekter som har en klart definert doseavhengighet.
- Erfaringene fra de russiske og europeiske skolene for ozonterapi viser at bruken av ozon som et terapeutisk middel øker effektiviteten av medikamentell behandling betydelig, og i noen tilfeller gjør det mulig å erstatte eller redusere den farmakologiske belastningen på pasienten. På bakgrunn av ozonterapi gjenopprettes pasientens egne oksygenavhengige reaksjoner og prosesser til den syke organismen.
- De tekniske egenskapene til moderne medisinske ozonisatorer med ultra-presise doseringsevner tillater bruk av ozon i området med lave terapeutiske konsentrasjoner som ligner på konvensjonelle farmakologiske midler.
Takk skal du ha
Nettstedet gir kun referanseinformasjon for informasjonsformål. Diagnose og behandling av sykdommer bør utføres under tilsyn av en spesialist. Alle legemidler har kontraindikasjoner. Ekspertråd er påkrevd!
1. Hva er ozon?Ozon - (fra gammelgresk - luktende) - en blåaktig gass med en skarp lukt, har sterke oksiderende egenskaper. Ozon er en allotrop modifikasjon av oksygen. Kjemisk formel - O 3. Tettheten av ozon er 2,5 ganger tettheten til diatomisk oksygen. Brukes til å desinfisere vann og luft.
2.
Hvordan oppstår ozon naturlig??
Det dannes fra diatomisk oksygen under en gassutslipp (strømstrøm gjennom en gass) eller under påvirkning av ultrafiolett stråling. Lukten av ozon kan kjennes på steder rike på oksygen: i skogen, nær havet eller en foss. Når det utsettes for ultrafiolett stråling, omdannes oksygen i vann til ozon. Også aromaen av ozon kan merkes etter et tordenvær, når det dannes under et lynutladning.
8.
Effekten av ozon på virus.
Ozon inaktiverer viruset ved å delvis oksidere skallet. Virusets evne til å dele seg og feste seg til cellene i kroppen er svekket.
9.
Hvordan nøytraliserer ozon mikroorganismer??
Ved kontakt av ozon med mikroorganismer, inkl. med sopp blir strukturen til membranen deres lokalt forstyrret, noe som dreper dem eller gjør det umulig å dele. Det er eksperimentelt bevist at ozon ødelegger alle typer prokaryoter, virus, sopp og encellede eukaryoter kjent for mennesket. Ozon i mengden 1-5 mg per liter vann i 5-20 minutter ødelegger E. coli, streptokokker, mykobakterier, Pseudomonas aeruginosa, Klebsiella, etc. med 99,9%.
10.
Kjemiske egenskaper til ozon.
Ozon reagerer med de fleste organiske og uorganiske forbindelser, og bryter dem ned til enklere stoffer. I prosessen med oksidasjon frigjøres vann, oksygen, karbonoksider, høyere oksider.
Alle disse stoffene er miljøsikre og danner ikke kreftfremkallende stoffer.
11.
Kan det dannes skadelige stoffer ved ozonering av luft i huset?
Prosentandelen av ozon produsert av et husholdningsapparat er trygt for mennesker; det danner ingen farlige stoffer i boligområder.
Ved ozonisering av en bolig øker konsentrasjonen av oksygen i luften, alle mikroorganismer og giftige stoffer elimineres. Perfluorkarboner, som vises i luften under drift av kjøleskap og klimaanlegg, brytes ned under påvirkning av ozon.
12.
Er det mulig å bli kvitt lukten av sigaretter eller lukten av maling, lakk i rommet ved å ozonisere luften??
Husholdnings ozonisatorer lar deg bli kvitt disse luktene. Luftozonering kan gjøres flere ganger.
13.
Hvilke stoffer dannes ved ozonering av inneluft?
De fleste stoffene rundt oss reagerer med ozon, og brytes ned til stoffer som er trygge for mennesker (karbondioksid, vann, diatomisk oksygen). I visse tilfeller frigjøres inaktive (ufarlige) stoffer (oksider). Det er også ikke-reaktive forbindelser - titandioksid, silisiumdioksid, kalsiumoksid, etc. De er ikke i stand til å reagere med ozon.
14.
Er det nødvendig å ozonisere luften når klimaanlegget går??
Når luft passerer gjennom klimaanlegg og radiatorer, synker konsentrasjonen av oksygen i luften, og konsentrasjonen av giftige partikler forblir på samme nivå. Dessuten forurenser og forgifter utdaterte klimaanlegg selv luften. Under slike forhold kan det utvikles hodepine, tretthet og hyppige akutte luftveisinfeksjoner. Ozonering av luft i slike lokaler eliminerer giftige komponenter og beriker luften med fritt oksygen.
15.
Kan et klimaanlegg behandles med ozon??
Ja det kan du.
16.
Hvor mye ozon i luften er nok til å eliminere bakterier og sopp i rommet?
En konsentrasjon på 50 ozonmolekyler per milliard luftmolekyler er tilstrekkelig for effektiv rensing. Spesielt effektivt ødelegger ozon Escherichia coli, salmonella, stafylokokker, candida.
17.
Har det blitt utført tester på effekten av ozon på mennesker?
Ozon har en gunstig effekt på en person. I fjellområder er luften beriket med ozon. Derfor bor det mange hundreåringer der.
Materialet, publisert i 1976 i tidsskriftet Nature, gir data om tester på effekten av ozon på mennesker. En av testene ble utført i seks måneder.
En gruppe mennesker var daglig i et rom der 15 ozonmolekyler utgjorde en milliard luftmolekyler. Folk bemerket en økning i tone, fjerning av nervøs spenning. Leger registrerte en økning i oksygeninnholdet i blodet, styrking av immunforsvaret, utjevning av blodtrykk og reduserte stresssymptomer.
18.
Kan ozon skade kroppen??
Husholdnings-ozonisatorer skaper en sikker konsentrasjon av ozon i luften, hvor mikrober og virus blir ødelagt, men cellene i menneskekroppen blir ikke skadet. Kroppens celler har en antioksidantmekanisme som beskytter dem mot å bli ødelagt av ozon. Dermed ødelegger ikke ozon alle levende organismer. Men dette betyr ikke at det er helt trygt. Når man ozoniserer luften i et rom, må folk forlate den. Ozonisatoren må oppbevares utilgjengelig for barn.
19.
Hvor mye ozon produserer en ozonisator?
0,4 g/time.
20.
Hvilken konsentrasjon av ozon lager en husholdnings-ozonisator??
Konsentrasjonen avhenger av størrelsen på rommet, av enhetens plassering i rommet, av den relative fuktigheten og lufttemperaturen.
Ozon er et ustabilt stoff og blir i løpet av kort tid til diatomisk oksygen, så konsentrasjonen av ozon avhenger av når ozoneringen ble utført. Gjennomsnittlige indikatorer for en husholdnings-ozonisator er 10-40 ozonpartikler per 1000000000 luftpartikler.
21.
Hva er den sikre grensen for ozonkonsentrasjon i luften?
Ozon forblir trygt hvis innholdet ikke overstiger 500-2500 partikler per milliard luftpartikler.
22.
Hvorfor behandles vann med klor??
Ved å klorere vann elimineres de fleste mikroorganismer.
23.
Hvorfor utviklede land har forlatt klorering?
Ved en viss konsentrasjon av klor i vann dreper det gunstige mikroorganismer i menneskets mage-tarmkanal. Ved å reagere med organiske molekyler, som inkluderer karbon, skaper klor kreftfremkallende stoffer som kan provosere alvorlige sykdommer (abort, sykdommer i hjertet og sirkulasjonssystemet, ondartede svulster).
24.
Hvorfor ozonisere vann?
Ozonering brukes til desinfeksjon, eliminering av urenheter, ubehagelig lukt og misfarging av vann. Ved tilberedning av drikkevann tas det hensyn til gassens desinfiserende og oksiderende egenskaper. Samtidig forbedrer den høye løseligheten av ozon i vann, etterfulgt av overgangen til diatomisk oksygen, kvaliteten og smaken. Samtidig endres ikke mineralsammensetningen i vannet.
Fjernet fra vannet:
- prokaryoter, virus, sporer, cyster (inkludert de som er resistente mot klor);
- organiske og uorganiske forbindelser, inkl. petroleumsprodukter, fenoler, svovelforbindelser, metaller, klor og dets forbindelser.
25.
Hvor intensivt skal enheten fungere ved ozonisering av vann?
Ozonatoren skal fungere i maksimal modus.
26.
Hvor mye ozon i vannet er nok til å desinfisere det??
Fullstendig desinfeksjon av vann oppnås ved 0,4-0,5 mg. gassformig ozon per liter vann.
27.
Hvordan ødelegger ozon mikroorganismer??
Ozon diffunderer gjennom cellemembranen og påvirker alle de viktigste organellene i cellen.
28.
Hvordan klor påvirker mikroorganismer?
Klor ødelegger bare noen organeller av bakterien, det virker mye langsommere, da det sakte diffunderer gjennom membranen og cytoplasmaet. Det er en rekke mikroorganismer som er ufølsomme for klor: giardia, cryptosporidium, amøbe, protozoer, cyster og andre.
29.
Hvorfor klor er ineffektivt for å eliminere sporer og cyster?
Sporer og cyster er tøffe skjell som noen mikroorganismer danner under ugunstige forhold. For å ødelegge dem trenger du en stor mengde klor og lang tid. Ozon ødelegger øyeblikkelig disse membranene og diffunderer inn i cellen.
30.
Hvordan fjerner ozon farge fra vann??
Organiske og uorganiske forbindelser som gir den farge fjernes fra vannet. Samtidig bryter ozon dem ned til enkle stoffer - vann, karbondioksid. Noen av de gjenværende stoffene kombineres og utfelles, som lett fjernes ved filtrering.
31. Hvorfor ozonering er å foretrekke fremfor andre vannbehandlingsmetoder?
- I motsetning til klorering og fluorering, ved behandling av vann med ozon, tilsettes ingenting fremmed (ozon blir raskt til diatomisk oksygen). Samtidig endres ikke mineralsammensetningen og surheten i vannet.
- Ozon ødelegger på kortest mulig tid alle typer mikroorganismer og virus.
- Alle organiske forbindelser i vannet brytes ned, og forhindrer utvikling av mikroorganismer og virus.
- De fleste giftige stoffer brytes ned til ufarlige stoffer. Kjemikalier ødelagt av ozon: plantevernmidler, ugressmidler, olje og dens derivater, vaskemidler, natriumsalter, svovel, nitrogen og kloridforbindelser, som er kreftfremkallende.
- Innholdet av asbest og tungmetaller reduseres.
- Med metaller danner ozon ikke-reaktive oksider (oksid av gelase, mangan, aluminium, etc.). Oksider utfelles og fjernes lett ved filtrering.
- Ved raskt å omdannes til diatomisk oksygen forbedrer ozon kvaliteten og smaken på vannet.
Dermed er ozonisert vann bakteriologisk og kjemisk ufarlig.
32
. Hvordan bestemmes tidspunktet for ozonering av vann??
Intensiteten av ozonoppløsning i vann er direkte proporsjonal med temperaturen på vannet og kontaktområdet mellom gassen og vannet. Jo lavere vanntemperatur og jo mindre dysestørrelse, jo mindre ozon løses opp. Jo varmere vannet er, desto raskere omdannes ozon til diatomisk oksygen og går tapt under fordampning.
Den nødvendige mengden ozon bestemmes i henhold til nivået av vannforurensning. I den russiske føderasjonen kreves det en ozonkonsentrasjon på 2,5 mg/l for å rense overflatevann på nordlige og midtre breddegrader. På sørlige breddegrader kreves det minst 8 mg/l.
33.
Hvordan reagerer ozon med jern og mangan?
Oppløst jern kan ofte finnes i overflate- og grunnvann. Kolloidene (0,1-9 mikron) kan ikke nøytraliseres med tradisjonelle metoder. Først må de oksideres. Mangan finnes vanligvis der. Disse kolloidene kombineres raskt med ozon for å danne uløselige oksider som utfelles og lett fjernes.
Organiske stoffer som inneholder jern og mangan blir først ødelagt av ozon, og deretter danner metallene oksider. Ozonering er den mest effektive måten å rense vann fra disse stoffene.
34.
Er det nødvendig å filtrere vann etter ozonbehandling??
Hvis vannet inneholdt organiske og uorganiske stoffer i høye konsentrasjoner, dannes det nedbør i det på grunn av ozonering. Etter ozonering må slikt vann filtreres. For dette formålet kan du bruke de vanlige rimelige filtrene. Samtidig vil de tettes ganske sakte.
35.
Er det mulig å ødelegge vannet ved for lang ozonering?
Ozonering av vann over tid forringer ikke vannkvaliteten. Ozon brytes raskt ned til diatomisk oksygen, noe som bare øker fordelene ved å drikke dette vannet.
36.
Hva er pH-nivået i vann etter ozonbehandling?
pH i ozonisert vann er 7,5-9. Dette vannet er ideelt å drikke.
37.
Hvordan øker konsentrasjonen av diatomisk oksygen i vann etter behandling med ozon?
Konsentrasjonen av oksygen i vann øker med 10-15 ganger.
38.
Hvor raskt blir ozon til oksygen i luft og vann??
Etter 10 minutter synker gassinnholdet i luften med 50 %, og danner diatomisk oksygen og vann.
I kjølt vann, etter 20 minutter, synker ozonkonsentrasjonen med 50 %, og danner hydroksyder og vann.
39.
Faktorer som bestemmer innholdet av ozon og oksygen i vann.
Innholdet av ozon og oksygen avhenger av oppløste stoffer, temperatur, pH-nivå, form og materiale i fartøyet.
40.
Hvorfor diatomisk oksygen ikke brukes?
Triatomisk oksygen er omtrent 10 ganger mer løselig i vann enn diatomisk oksygen. Jo kaldere vannet er, desto langsommere brytes ozon ned til diatomisk oksygen.
41.
Hva er fordelene med å oksygenere drikkevann??
Glukosemetabolismen stimuleres, oksygenering av blodserum økes, oksygentilførsel til alle organer og vev stimuleres, blodsirkulasjonen i kapillærene forbedres.
Stoffskiftet i lever og nyrer er normalisert.
Hjertet styrkes.
Respirasjonsfrekvensen avtar på grunn av økningen i volumet av innåndet luft.
42.
Hvor mye tid er nok for ozonering av vann?
Jo flere urenheter i vannet, jo mer tid trengs for ozonering. Dermed varer den effektive behandlingen av tre liter vann fra springen 15 minutter. Samme vannmengde tatt fra en overflatevannkilde, avhengig av årstid og forurensningsgrad, ozoniseres i 50-60 minutter.
43.
Hvilken kapasitet er egnet for ozonisering av vann?
Glassbeholdere med smal munn er foretrukket for å redusere tap av ozon.
44.
Når er det bedre å ozonisere vann til varme drikker - før eller etter koking??
For å lage te, bør vannet ikke bringes til 100 grader. Den optimale temperaturen er 90 grader. Vann bør ozoniseres før oppvarming.
45.
Hvorfor behandle mat med ozon?
Organiske og uorganiske giftige forbindelser, virus, muggsopp, helmintlarver elimineres fra matvarer.
Kylling, storfekjøtt, svinekjøtt dyrket på store gårder mates med antibiotika og steroider. Planter gjødsles med kunstgjødsel og sprøytes med sprøytemidler.
Disse forbindelsene, som kommer inn i kroppen med mat, er helseskadelige, og er hovedfaktorene i metabolske forstyrrelser.
Når matvarer ozoniseres, brytes alle giftige forbindelser ned, noe som gjør produktene trygge å spise.
46.
Må korn behandles med ozon??
Ja trenger.
47.
Hvordan ozonisere kjøtt?
Hvis kjøttet er frosset, må det først tines. Skjær i 20-25 cm tykke biter og legg i en beholder med vann i 10 minutter. Ozon i 15-25 minutter.
48.
Trenger jeg å ozonisere mat beregnet for langtidslagring??
Anbefalt.
49.
Bryter ozon ned næringsstoffene som finnes i mat??
Alle nyttige stoffer er bevart.
50.
Må egg ozoneres??
Ozonering av egg forlenger holdbarheten og beskytter mot inntrengning av salmonellabakterier.
51.
Hvordan ozonere vodka?
Vodka behandles på samme måte som vann (15-25 minutter).
52.
Omfang av husholdnings ozonator.
En husholdningsozonisator kan brukes til følgende formål:
- desinfeksjon og eliminering av ubehagelige lukter i luften i rom, møbler, husholdningsapparater, etc.;
- forberedelse av drikkevann (desinfeksjon, oksygenering, eliminering av klor og andre farlige stoffer);
- forbedre kvaliteten på maten (grønnsaker, frukt, kjøtt, fisk, egg);
- kosmetikk (behandling av flass, akne, gurgling, forbedring av tilstanden til tenner og tannkjøtt, behandling av soppinfeksjoner);
- desinfeksjon av kjæledyr og fisk;
- stell av stueplanter;
- forbedre tilstanden til lin;
- skopleie.
53.
Er ozonterapi brukt i internasjonal terapeutisk praksis?
Det er International Ozone Association, som jevnlig arrangerer kongresser hvor problemene med å bruke ozon i behandling av ulike patologier og til helseformål diskuteres.
54.
Hva er effekten av å bruke ozon i klinisk praksis?
Ozon ødelegger alle kjente typer mikroorganismer og virus. Den aktiverer og stimulerer en rekke fysiologiske prosesser.
Som et resultat av bruken av ozon er det:
- aktivering av selvrensende prosesser, undertrykkelse av aktiviteten til giftige stoffer;
- gjenoppretting av metabolisme;
- forbedring av kapillær blodstrøm;
- blodfortynnende;
- forbedre tilførselen av celler med oksygen;
- gjenoppretting av immunitet;
- hemming av lipidperoksidasjonsprosessen;
- aktivering av kroppens antioksidantaktivitet (gjenoppretter balansen mellom lipidperoksidasjon og antioksidantbeskyttelse);
- eliminering av betennelse;
- anestesi.
55.
Hva er målene med å bruke ozonterapi i klinisk praksis?
Desinfeksjon av åpne sår, brannskader, soppinfeksjoner, liggesår, ikke-helende sår.
Bruk av ozon som et hemostatisk middel (i høye konsentrasjoner).
For helbredelse av sår, sår, etc. (i små konsentrasjoner).
I klinisk praksis brukes en ozon-oksygenblanding oppløst i fysiologisk saltvann for behandling av tarmpatologier, under kirurgiske operasjoner etc. Systemisk ozonterapi praktiseres også gjennom injeksjoner av ozonløsninger.
Ozonterapi er effektiv innen alle medisinske områder:
- restaurering av tarmfloraen;
- gjenoppretting av transportfunksjonen til tykktarmen og tynntarmen;
- behandling av patologier i hjertemuskelen og sirkulasjonssystemet, sykdommer i leddene;
- behandling av infeksjonspatologier, inkl. herpetisk infeksjon, viral hepatitt;
- hudpatologier, etc.
56.
Ta et bad i ozonisert vann.
Det tas for å normalisere blodstrømmen, helbrede sår, eliminere hudpatologier, aktivere selvrensing av kroppen og øke respirasjonsvolumet.
Badevann bør behandles ved en temperatur på 40 grader. Badet skal være ventilert. Ta et bad i ikke mer enn 20 minutter. Det anbefales ikke å gå i vannet under hjertets nivå.
Hvis rommet er dårlig ventilert, er det nødvendig å puste gjennom en våt klut for å beskytte slimhinnen fra å tørke ut.
57.
Hvordan ozonisert vann påvirker mennesker som lider av hjerte- og karsykdommer?
De gunstige effektene av ozonisert vann er dokumentert i medisinsk praksis.
Hvori:
- konsentrasjonen av kolesterol i blodplasma reduseres;
- reduserer sannsynligheten for blodpropp;
- på grunn av forbedret oksygentransport, gjenopprettes normal cellulær respirasjon.
58.
Hvorfor blir svette aktivert etter å ha tatt et bad i ozonisert vann?
Dette er på grunn av rensing av porene. Det samme kan observeres etter badet.
59.
Kan ozonisert vann brukes til å fjerne sminke??
Huden renses mer effektivt, alle porer frigjøres.
60.
Kan du bruke ozonisert vann når du pusser tennene??
Utvilsomt. Sterkt anbefalt i behandling og forebygging av periodontitt.
61.
Hvordan kurere flass?
Skyll håret regelmessig med ozonisert vann.
62.
Bør mineralvann behandles med ozon??
Under ozonering endres ikke mineralsammensetningen av vann, og vannet desinfiseres og berikes med oksygen.
63.
Hvor bra er flaskevann??
Ofte skjer forurensning og forurensning av flaskevann enten ved kilden (på grunn av miljøsituasjonen) eller ved fabrikken. Eksperter fra World Wildlife Fund har fastslått at en tredjedel av alle europeiske merker av flaskevann inneholder ekskrementer (restene av den vitale aktiviteten til mikroorganismer og virus).
64.
Hva er forskjellen mellom industrielle, medisinske og husholdningsapparater for ozonisering?
Industrielle enheter skaper en høy konsentrasjon av ozon, uakseptabelt for små rom.
Medisinsk utstyr og husholdningsapparater gir omtrent samme konsentrasjon, men medisinsk utstyr er designet for langsiktig kontinuerlig drift. Medisinsk utstyr er koblet til en kilde med rent oksygen for å produsere ren ozon uten urenheter.
65.
Hva er effektiviteten av ozon innen desinfeksjon sammenlignet med andre metoder for desinfeksjon?
Ozon ødelegger alle typer mikroorganismer og virus 3-6 ganger mer effektivt enn ultrafiolett stråling og 400-600 ganger mer effektivt enn klor og dets forbindelser. I tillegg ødelegger ozon mikroorganismer som er resistente mot klor (cyster, herpesvirus, Kochs basill).
66.
Er det mulig å behandle kjøkkenutstyr med ozon?
Sikkert. Det er spesielt praktisk å behandle barneretter, hermetikkbeholdere, etc. For å gjøre dette er det nødvendig å senke oppvasken i en beholder fylt med vann, senk slangen med en dyse til bunnen av beholderen. Slå på enheten i 10-15 minutter.
67.
Er det mulig å ozonisere vannet i akvariet uten å fjerne fisken?
Vannet i akvariet er beriket med oksygen, deodorisert, mikroorganismer blir ødelagt. Forbedrer helsen til fisk og akvariealger.
68.
Hva skal lages av en beholder for ozonering av vann?
Akseptable beholdere er laget av glass, keramikk, tre, plast, emaljert metall (ingen spon). Ikke bruk beholdere laget av metaller (inkludert aluminium og kobber). Gummi forringes ved eksponering for ozon.
69.
Kan ozonering bidra til å eliminere dårlig lukt fra sko??
Ja! For å gjøre dette, legg skoene i en plastpose. Fjern munnstykket fra slangen. Plasser enden av slangen inne i støvelen, i tåområdet. Forsegl posen (ikke klem i luftslangen). Slå på enheten i 10-15 minutter.
70.
Hva bør være en husholdnings ozonisator?
Husholdningsapparater for ozonisering må være helt trygge for mennesker. Konsentrasjonen av ozon i luften og i vannet som skapes av enheten må ikke overskride sikkerhetsgrensen for mennesker.
71.
Hvordan lager maskinen ozon??
Ozon dannes fra oksygen som kommer inn i maskinen gjennom en pumpe. På grunn av gassutslippet brytes diatomiske oksygenmolekyler opp i individuelle atomer. Frie atomer kombineres midlertidig med molekyler av diatomisk oksygen. Slik dannes ozon.
72.
Hvor lenge kan en hjemmeozonisator vare??
Garantiperiode - 1 år.
Den omtrentlige levetiden til enheten er 5-10 år (når du ikke jobber mer enn 6-7 timer om dagen).
Tid for kontinuerlig drift - ikke mer enn 40 minutter med en minimum pause på 10 minutter.
73.
Hvor du skal plassere en ozonisator?
Ozonatoren må plasseres så høyt som mulig, pga. ozon er tettere enn luft.
Ved ozonisering av vann, for å forhindre utstrømning av vann inn i enheten, må det være over tanken. Hvis vann har trengt inn i apparatet, skal det umiddelbart kobles fra strømnettet og overleveres for vedlikehold.
74.
Hvorfor trengs en splitter? Forurenser det vannet?
Skilleren (diffus stein) brukes til å ozonisere vann og er nødvendig for å øke kontaktområdet mellom ozon og vann. Steinen i seg selv reagerer ikke med gassen. Ved å være i kontinuerlig kontakt med ozon kan det ikke spre forurensning. Diffus stein brukes kun til vannbehandling. I mindre flytende væsker kan steinen bli tilstoppet. Væsker som melk eller vegetabilsk olje kan ozoniseres ved å senke en luftledning uten en dyse inn i dem.
75.
Hvordan finne ut om enheten fungerer?
Enheten er defekt hvis:
- ingen karakteristisk aroma av ozon;
- det er ingen støy fra enheten;
- Maskinen bråker for mye.
76.
Hva er den maksimalt tillatte tiden for kontinuerlig drift av ozonisatoren?
For å forlenge levetiden til enheten, anbefales det å slå den av i 10-15 minutter hvert 40. minutt.
Vannbehandling med gassformig O 3 ozon er en lovende moderne trend innen vannbehandling. Ozon, på grunn av sine høye oksiderende egenskaper, kan effektivt ødelegge patogen bakteriell mikroflora og oksidere mange organiske forbindelser og metaller med deres påfølgende nedbrytning.Vannozonering er lovende i vannbehandling av drikkevann og vann brukt til husholdningsbehov, desinfeksjon av avløpsvann, sirkulerende vann i svømmebassenger, desinfeksjon av vann beregnet på tapping, fjerning av ubehagelig smak og lukt fra vann, samt for desinfeksjon av industri og husholdningslokaler og luftfjerning. Denne artikkelen diskuterer hovedaspektene ved bruk av ozon i vannbehandling.
Rensing og fremskaffelse av drikkevann egnet for konsum er et viktig skritt i vannbehandlingen. I henhold til den tradisjonelle ordningen inkluderer vannbehandling vanligvis tre hovedtrinn: mekanisk filtrering, fjerning av suspenderte og kolloidale stoffer fra vann (klaring) og desinfeksjon. Fjerning av suspendert materiale fra vann oppnås ved hjelp av sorpsjonsmetoder og filtre. For å rense vann brukes kjemisk behandling med spesielle koagulanter (aluminiumsulfat Al (SO 4) 3 18H 2 O, jernsulfat FeSO 4 7H 2 O, jernklorid FeCl 3 6H 2 O), som er i stand til å utfelle kolloidale partikler av jern eller aluminium hydroksider med forurensninger adsorbert på dem, opptil 0,07 mikron i størrelse. For vanndesinfeksjon brukes behandling med klor og dets derivater (kloroksid (ClO 2), natriumhypoklorid NaOCl) som inneholder 95-97 % aktivt klor. Behovet for å bruke tre forskjellige prosesser er avgjørende kompliserer vannbehandlingsteknologi. På grunn av de betydelige kostnadene for sorpsjonsanlegg og kompleksiteten til den teknologiske prosessen med vannbehandling, er det ofte nødvendig å neglisjere forbedringen av smaken av vann. Når vann behandles med koagulanter, kommer ytterligere forurensninger inn i vannet; klorering fører på sin side til dannelse av giftige farlige klororganiske forbindelser i vann.
Et alternativ til klorering i vannbehandling er vannbehandling med ozon. Ozon er en blåfarget gass med en karakteristisk skarp lukt, dannet når luft utsettes for en elektrisk utladning eller ultrafiolett stråling. Ved lave temperaturer (-112 °C) blir ozon til en mørkeblå væske, og ved dypere avkjøling danner det mørke lilla krystaller. T-smelte - 192,7 °C, Tbp - 111,9 °C, løselighet i vann ved 20 °C 0,0394 vekt-% (tabell 1).
Tabell 1
Grunnleggende fysiske og kjemiske egenskaper til ozon
Parameternavn
Betydning
Molekylær vekt
49 g/mol
Kokepunkt (1 atm.)
Smeltepunkt (1 atm.)
Tetthet (0 °С)
Løselighet i vann (20 °C)
0,0394 masse%
Ozon brukes til rensing og etterbehandling av drikkevann, tilberedning av vann for produksjon av øl og brus, sterilisering av glass- og plastflasker fra polyetylentereftalat (PET), ozonering av vann i svømmebassenger, desinfisering av avløpsvann, industri, tilbudslokaler og fellesarealer m.m.
I henhold til graden av fare tilhører ozon den første klassen av skadelige stoffer.
- Maksimal engangs maksimal tillatt konsentrasjon (MAC m.r.) av ozon i den atmosfæriske luften i befolkede områder er 0,16 mg/m³.
- Gjennomsnittlig daglig maksimal tillatt konsentrasjon (MPC mc) av ozon i den atmosfæriske luften i befolkede områder er 0,03 mg/m³.
- Maksimal tillatt konsentrasjon (MAC) av ozon i luften i arbeidsområdet er 0,1 mg/m³.
Kjemiske egenskaper til ozon
I henhold til sin kjemiske struktur er ozon et molekyl som består av tre oksygenatomer med en bindingslengde på 1,278 Å 0 og en bindingsvinkel på 116,8 0 (fig. 1). Ozonmolekylet er polart, dipolmomentet er 0,534 D.
Ris. 1. Kjemisk struktur av ozonmolekylet
Ozon er ustabilt og blir under normale forhold (20 0 C, 1 atm.) spontant til oksygen O 2 med generering av atomært oksygen og frigjøring av varme. Halveringstiden for ozon i luft er 30-40 minutter. En økning i temperatur og en reduksjon i trykk øker overgangshastigheten for ozon O 3 til O 2 . Ved høye konsentrasjoner av O 3 kan prosessen være eksplosiv. Kontakten av ozon med selv små mengder organiske stoffer, noen metaller eller deres oksider akselererer omdannelsen av O 3 til O 2.
Ozon er et sterkt oksidasjonsmiddel og danner ozonider med mange umettede organiske forbindelser - mellomprodukter av tilsetning av ozon til dobbeltbindingen. Det primære produktet av ozoninteraksjon er en malozoid (1,2,3-trioksolan), som er ustabil og spaltes til karbonyloksid [>C=O-O]* og karbonylforbindelser - aldehyder eller ketoner (skjema).
Opplegg. Ozoneringsreaksjon av umettede organiske forbindelser (Krige-reaksjon)
Ozoneringsreaksjonen er ekstremt eksoterm, overskuddsvarme brukes på den elektroniske vibrasjonseksitasjonen av de resulterende reaksjonsproduktene og spres delvis av løsemiddelmolekyler. Mellomproduktene som dannes i denne reaksjonen reagerer igjen i en annen rekkefølge, og danner ozonider. I nærvær av stoffer som er i stand til å reagere med karbonyloksid (alkoholer, syrer), dannes forskjellige peroksidforbindelser i stedet for ozonider.
Ozon reagerer aktivt med aromatiske organiske forbindelser, og reaksjonen fortsetter både med ødeleggelsen av den aromatiske kjernen og uten dens ødeleggelse. Samspillet mellom ozon og fenoler resulterer i dannelse av forbindelser med en forstyrret aromatisk kjerne (som kinoin), samt lavtoksiske derivater av umettede aldehyder og syrer.
I reaksjoner med mettede hydrokarboner som forekommer i vandige løsninger, brytes ozon først ned med dannelse av atomært oksygen, som initierer kjedeoksidasjon. I dette tilfellet tilsvarer utbyttet av oksidasjonsprodukter nivåene av ozonforbruk.
Ozon er også i stand til å interagere med alkalimetaller - natrium (Na), kalium (K), rubidium (Rb), cesium (Cs), gjennom dannelsen av et mellomliggende ustabilt kompleks av metallkation med ozon [M + - O - H + - O 3 - ] *, som et resultat av påfølgende vandig hydrolyse hvorav en blanding av ozonid MO 3 og vandig alkalimetallhydroksid (MOH) dannes.
Den bakteriedrepende effekten av ozon
Ozon er et sterkt desinfeksjonsmiddel som har en uttalt bakteriedrepende effekt på mange patogene mikroorganismer, bakterier og virus. Ved evaluering av effektiviteten til ozon brukes C·T-kriteriet, dvs. produktet av reagenskonsentrasjonen og tidspunktet for dets virkning. Ozon er overlegen i sin desinfiserende virkning enn klor, kloramin og klordioksid (tabell 3).
Mekanismen for den bakteriedrepende virkningen av ozon forklares av dens høye oksidasjonsevne. Ozon virker som et sterkt oksidasjonsmiddel på celleveggen til mikroorganismemembraner med påfølgende penetrasjon inn i cellen og oksidasjon av vitale biologisk aktive forbindelser (proteiner, enzymer, DNA, RNA). På grunn av sine oksiderende egenskaper ødelegger ozon bakterier 3-5 ganger mer effektivt enn UV-stråling og 500-1000 ganger sterkere enn klor.
Tabell 3
C-verdi· T-kriterium for ulike mikroorganismer (99 % inaktivering ved 5-25 ° C. C· T-kriterium (Mb/l· min))
- Type mikroorganismer; Ozon; Gratis klor; kloramin; klordioksid
- Escherichia coli E. coli; 0,02; 0,03-0,05; 95-180; 0,4-0,75
- Poliovirus; 0,1-0,2; 1,1-2,5; 770-3470; 0,2-6,7
- Retrovirus; 0,006-0,06; 0,01-0,05; 3810-6480; 0,2-2,1
- Gardialamblia (cyster); 0,5-0,6; 47-150; -; -
- Voktere; 1,8-2,0; 30-630; 1400; 7,2-18,5
- Cryptosporidium; 3,2-18,4; 7200; 7200; 78
Ozon er mer effektivt enn klor til å drepe E. coli Echerihiacoli, som i vann ødelegges av ozon 1000 ganger raskere enn av klor. Tiden det tar å ødelegge Endamoeba hystolica ved en restkonsentrasjon av ozon i vann på 0,3 mg/l er det 2-7,5 minutter, og for klor (restkonsentrasjon på 0,5-1 mg/l) - 15-20 minutter. Polioviruset ødelegges av ozon på 2 minutter ved en konsentrasjon på 0,45 mg/l, mens når vann behandles med klor i en konsentrasjon på 1 mg/l, tar dette 3 timer.
Metoder for å oppnå ozon
Kjemisk metode utføres ved reaksjonen mellom vismutpentafluorid (BiF 5) og andre sterke oksidasjonsmidler med vann. Ozon dannes også i mange prosesser ledsaget av frigjøring av atomært oksygen, for eksempel under dekomponering av peroksider, oksidasjon av fosfor, etc.
elektrolytisk metode er realisert i spesielle elektrolyseceller. Løsninger av forskjellige syrer og deres salter (H 2 SO 4 HClO 4 NaClO 4 KclO 4) brukes som elektrolytter. Dannelsen av ozon skjer på grunn av nedbrytning av vann og dannelse av atomært oksygen, som ved å sammenføye et oksygenmolekyl danner ozon O 3 . Denne metoden gjør det mulig å oppnå ozon med høye utbytter, men på grunn av sin energiintensitet er den ikke mye brukt.
Fotokjemisk metode er basert på dissosiasjonen av et oksygenmolekyl under påvirkning av kortbølget UV-stråling med en energi på 4,13 - 6,20 eV. En lignende prosess finner sted i de øvre lagene av atmosfæren, hvor, under påvirkning av solstråling, den såkalte. ozonlag. Metoden har funnet anvendelse innen medisin, næringsmiddelindustri, etc.
Elektrosyntese i en gassutladning- barriere, overflate og pulsert, er mest brukt i industrielle og innenlandske ozongenererende installasjoner. Denne metoden gjør det mulig å oppnå høye konsentrasjoner av ozon med høy produktivitet og lavt energiforbruk av utstyret.
Bruk av ozon i vannbehandling
Vannozonering i vannbehandling har en rekke ubestridelige fordeler i forhold til andre eksisterende teknologier, inkludert vannklorering (tabell 2). En viktig fordel er manglende evne til ozon, i motsetning til klor, til å substituere reaksjoner med organiske forbindelser, noe som fører til dannelse av sidetoksiske organoklorforbindelser - trihalometaner, hvor den viktigste representanten er kloroform (CHCl 3). Det er kjent at i prosessen med vannklorering kan det dannes opptil 50 forskjellige halogenholdige forbindelser, inkludert bromoform (CHBr 3), dibromklormetan (CHBr 2 Cl), bromdiklormetan (CHBrCl 2) og kloroform (CHCl 3).
Ozonering i vannbehandling fører ikke til dannelse av trihalometaner og gjør det på grunn av ozonets høye oksidasjonskraft mulig å oppnå klaring av vann og sedimentering av urenheter, samt eliminere smak og lukt under desinfeksjon. I mange egenskaper, inkludert den komplekse indikatoren for toksisitet og mutagen aktivitet, er ozon overlegen klor og dets derivater (tabell 2).
tabell 2
Sammenlignende egenskaper ved ozonering og vannklorering
Parameter
Vannklorering
Vann ozonering
Gratis restreagenskonsentrasjon
ikke mindre enn 0,5 mg/l
ikke mer enn 0,3 mg/l
PH verdi
Turbiditet
Opptil 2 mg/l
opptil 7 mg/l
Reagenskontakttid med vann
minst 30 minutter
opptil 5 minutter
Ødeleggelse av E. coli
Virusødeleggelse
Kompleks indikator på toksisitet og mutagen aktivitet
3 ganger økning
reduksjon med 2,5 ganger
organiske forbindelser
dannelse av trihalometaner, kloraminer, dioksiner, etc.
ødeleggelse av organisk karbon, inkl. organiske klorforbindelser
Oppløst oksygen
Opptil 50 % reduksjon
øke opp til 100 %
Metallioner: Fe, Mn, Al, Pb, Hg, etc.
fortsette
oksidert opp til 90 %
Når det er oppløst i vann, brytes ozon ned til O 2 med generering av reaktivt atomært oksygen, som er i stand til raskt å oksidere organiske og uorganiske forurensninger, og overføre dem fra en oppløst tilstand til suspensjoner som holdes tilbake av et sorpsjonsfilter.
I følge moderne teknologi utføres ozonproduksjon på forbruksstedet på spesielle installasjoner - ozongeneratorer som genererer ozon med en høyfrekvent koronautslipp i en strøm av tørket luft. Energiforbruket i denne prosessen er 5–15 kW/kg O 3 ·h, konsentrasjonen av ozon i luft-ozonblandingen er 50–250 g/m 3 . Den resulterende ozonen mates deretter inn i vannbehandlingssystemet for bobling og injeksjon.
I store industrielle installasjoner er det mest vanlig å spre en ozon-luftblanding. gjennom renset vann. Samtidig er et viktig teknologisk skritt å sikre samme kontakttid for gassformig ozon med vann, samt dens ensartede innføring i hele volumet av behandlet vann.
I installasjoner med relativt liten ozonkapasitet er injeksjonsmetoden den vanligste og ganske effektive. Det rensede vannet, som passerer gjennom injektoren, skaper et vakuum i det, hvor den nødvendige mengden gassformig ozon kommer inn i vannet. Intensiv blanding i injektoren sprer ozon til små bobler med en stor kontaktflate, noe som øker oppløsningshastigheten av ozon i vann.
For bedre oppløsning av ozon i vann brukes pulserende kolonner med spesielle fordelingsplater. Ozon-luftblandingen kommer inn i bunnen av kolonnen; den frem- og tilbakegående bevegelsen av vann, skapt av en spesiell pulsator, og distribusjonsplater sørger for at den spres til bobler av forhåndsbestemte optimale størrelser, som stiger i motstrøm til den nedadgående vannstrømmen. Som et resultat oppnås en høy grad av ozondispersjon med en høy spesifikk produktivitet av apparatet.
Etter oppløsning av ozon i vann er det nødvendig å sørge for en viss tid for kontakt med vann for gjennomføring av kjemiske oksidasjonsreaksjoner og fjerning av en overflødig mengde ureagert ozon og nedbrytningsprodukter fra vannet. Til dette brukes et kontaktfilterapparat, hvorfra vann ledes til et karbonfilter basert på aktivt kull for katalytisk oksidasjon. produkter fra samspillet mellom ozon og organiske forbindelser, etterfulgt av deres retensjon av filteret og ozonødeleggelse (fig. 2).
Ris. 2. Skjematisk diagram av vannozonisatoren
Bruken av moderne avanserte ozonproduksjonsteknologier gjør det mulig å lage små, pålitelige, høyytende og enkle å justere og vedlikeholde ozoneringssystemer for husholdningsvann utstyrt med elektroniske kontrollsensorer og kontrollsystemer (fig. 3).
Ris. 4. Skjematisk diagram av vannozoneringssystemet. OB - lufttørker; O1 - ozonisator; DU1, DU2 – nivåsensorer; DO - ozonødelegger; H - pumpe; OK1 - tilbakeslagsventil til ozonlinjen; M - manometer; I - injektor; YA1 - magnetventil.
konklusjoner
Fordelene med ozon fremfor kloreringsteknologi er:
- Ozon er miljøvennlig og danner ikke giftige biprodukter av forråtnelse.
- Rester av ozon blir raskt til oksygen.
- Ozon produseres på stedet for vannbehandling, uten at det krever lagring og transport.
- Ozon ødelegger alle kjente mikroorganismer: virus, bakterier, sopp, sporer, cyster, protozoer, etc. 300-1000 ganger raskere enn andre desinfeksjonsmidler.
- Ozonresistente former for mikrober eksisterer ikke og kan ikke oppstå.
- Behandling av vann med ozon tar flere minutter.
- Ozonering fjerner ubehagelig lukt og smak fra vann.
- Samtidig med desinfeksjon skjer vannavklaring.
Ulempene med ozon inkluderer kompleksiteten til produksjonen på stedet for direkte bruk, behovet for betydelige energikostnader forbundet med produksjonen, samt den utilstrekkelig høye stabiliteten til ozon i vann, som brytes ned i det innen 30-40 minutter.
Litterære kilder:
Mosin O.V. Bruk av ozon i vannbehandling // Santekhnika, 2011, ; 4, s. 47-49.
» artikkel Ozon for vannbehandling. Hvor skal vi snakke om bruken av denne gassen for å skape renere vann.
Ozon for vannbehandling er en tidtestet teknologi. I mer enn et århundre har europeiske land brukt ozonering som den foretrukne metoden for vannrensing. Frankrike var det første landet som brukte ozon i vannbehandling.
Hovedforskjellen mellom ozon som reagens ved vannbehandling sammenlignet med andre stoffer er at det produseres fra omgivelsesluft uten behov for å kjøpe erstatningselementer, reagenser osv.
Ozon er en aktiv kjemisk forbindelse som består av tre oksygenatomer. Denne forbindelsen er stabil, det tredje ekstra oksygenatomet spaltes lett av og interagerer superaktivt med de omkringliggende forbindelsene. Teknologien for vannozonering er basert på dette fenomenet.
Ozon, på grunn av sin økte reaktivitet, oksiderer organiske urenheter, gjør dem uløselige, fremmer deres forgrovning og øker dermed effektiviteten til de neste stadiene av vannrensing, hvor disse forbindelsene filtreres ut.
Ozon oksiderer jern, mangan, tungmetaller oppløst i vann, omdanner dem til en uløselig tilstand og letter deres videre fjerning.
Ingen ubehagelige eller skadelige lukter. Hvis hydrogensulfid og ammoniakk er tilstede i vann, eliminerer ozonering av vann disse stoffene fullstendig.
Ozon har en delvis antiavleiringseffekt. Vannozonering bremser dannelsen av kalsiumsalter på veggene i en varm rørledning og fjerner delvis eksisterende kalkavleiringer.
Moderne ozonteknologier blir mindre og rimeligere på grunn av bruken av halvledere. Siden effekten av ozonering er kompleks, er det mulig å sørge for inkludering av denne teknologien ved rensing av vann for hele huset i mange tilfeller, spesielt med "tungt" vann.
Et eksempel på organisering av vannrensing ved bruk av ozon.
Dette er ikke en oppskrift på alle sykdommer, det er et forsøk på å vise ved eksempel hvordan ozonering kan brukes i vannbehandling.
Anta situasjonen: kildevann inneholder 2,5 mg/l oppløst jern, oksiderbarhet 12 mgO2/l, turbiditet 5 mg/l, farge 30 grader. Det vil si at vannet er grumsete, grønt, mye organisk materiale og jern. Ikke den verste situasjonen, en enkel jernfjerner klarer dette. Men la oss si at vi skal bruke rimeligere ozonering.
Det er en tommelfingerregel at dosen av ozon for vannbehandling for fjerning av jern er 0,14*, det vil si 0,14 ganger jernkonsentrasjonen. Dessverre husker jeg ikke kilden. I vårt tilfelle vil ozondosen være 0,35 mg/l. Siden oksiderbarhet er en kompleks indikator, og det faktisk ikke er kjent hva som er der, er det mulig å nøyaktig beregne dosen av ozon bare i praksis. Omtrent ozon i vårt eksempel trenger 2 mg/l. Følgelig trengs 2000 milligram ozon, eller 2 gram, per 1000 liter. 1000 liter er mengden vann som en familie på 3-4 personer trenger per dag.
Ozonisatorer er delt inn etter produktivitet: 1 g/time, 2 g/time, 4 g/time, etc. Jo flere gram per time, jo dyrere. Anta at vi har valgt en ozonator for 1 g/time. Så, ifølge vårt eksempel, vil det ta 2 timer å behandle vann. Hvordan skal vi levere ozon? Det er veldig enkelt - å gurgle med en kompressor i en lagertank. Luftbobler mettet med ozon passerer gjennom vannet, oksiderer alt som kan oksideres, og sprekker på overflaten av vannet. Ubrukt ozon må fjernes, da ozon er ganske giftig. For å gjøre dette er et aktivt kullfilter installert ved utløpet av tanken, som bryter ned ozon. Alt dette bør være i et godt ventilert område.
Vann legger seg, jern og organiske stoffer blir grove, og de kan allerede filtreres ut ved neste trinn av vannrensing ved hjelp av konvensjonelle mekaniske filtre av patrontype. Det vil ikke være overflødig å ha et aktivt kullfilter og et mesh-backwash-filter. Men det må allerede ses på i form av penger.
Så vi trenger: en ozonator med en kapasitet på 1 g / time, en lagringstank på 1000 liter, en kompressor for å tilføre en ozon-luftblanding til tanken, et ozontilførselssystem til tanken, et grovfilter, en pumping stasjon, mekanisk vannrensing filtre.
Skjematisk vil det se slik ut:

Så, vann kommer fra en brønn, samles i en tank. Vannstanden styres av en flottør fra en nedsenkbar pumpe og en magnetventil. Alt sammen er koblet til en timer, som gjør at vann kun kan fylles om natten. En annen timer inkluderer en ozonator og en kompressor for å tilføre en luft-ozonblanding til vannet. Timeren er programmert for 2 timers drift. Etter 2 timer slår den av ozonatoren og kompressoren.
I løpet av disse 2 timene kommer ozon med luft inn i tanken gjennom en slange med hull for jevn tilførsel av ozon gjennom hele tankens volum. Jern oksideres, organiske stoffer oksideres, de blir større og feller ut.
Deretter reiser innbyggerne seg opp, åpner kranen - og pumpestasjonen leverer det allerede rensede vannet gjennom en rekke filtre (for eksempel 100 mikron mesh, 30 mikron patron korrugert, 5 mikron patron og aktivt kullfilter) inn i hus.
Som et resultat inneholder ikke vann jern og har mye mindre organisk materiale.
For at fjerningen av urenheter skal bli mer fullstendig, økes ozoneringstiden ganske enkelt. Rekkefølgen på eksperimentet er enkel - de helte vann i tanken, passerte ozon i 2 timer, en time, 3 timer, 4 timer og sammenlignet utseendet til vannet.
Det må huskes at i forurenset vann brytes ozon nesten fullstendig ned og blir trygt for mennesker på 20, og for å være sikker, på 30 minutter. Det vil si at du kan drikke vann først etter denne tiden.
Vi teller tiden: begynnelsen av å fylle tanken klokken ett om morgenen. Fylling av tanken 2 timer - 3 am. Tiden for ozonødeleggelse i vann er 30 minutter. 03:30 Vannet er klart til bruk.
Kostnaden for prosjektet er minimal, av de utskiftbare elementene - bare patroner for mekanisk rensing av karbonfiltrering, som ville være tilstede i enhver vannbehandlingsplan - både med og uten ozon. Det er ingen andre utskiftbare elementer og forbruksvarer - ingen erstatning av den katalytiske belastningen, ingen kostnader for kaliumpermanganat eller salt.
Hvor får du tak i ozongeneratorer? Mest fra de selskapene som driver med svømmebasseng. De vil spørre og vise, og muligens installere.
Dermed er ozonering, med riktig tilnærming, en kompleks vannbehandling.

Basert på materialer http://voda.blox.ua/2008/10/Kak-vybrat-filtr-dlya-vody-34.html