Dersin amacı ve hedefleri:
– öğrencilerin benzen molekülünün yapısı ve hazırlanma yöntemleri hakkındaki bilgilerini sistematik hale getirmek;
- benzenin fiziksel ve kimyasal özelliklerine ilişkin bir anlayış oluşturmak, benzenin karakteristik kimyasal reaksiyonları için denklemlerin nasıl oluşturulacağını öğretmek;
– öğrencilerin video materyalleri ve multimedya sunumlarıyla çalışma becerilerini geliştirmeye devam edin.
Çalışma biçimleri: ön, bireysel.
Ekipman: bilgisayar, multimedya projektörü, “Benzol” masaları
Ders ilerlemesi
I. Organizasyon anı.
Öğretmen: Dersin konusu, amaçları ve hedefleri.
II. Öğrencilerin bilgilerinin etkinleştirilmesi.
- Ön anket
- Aromatik hidrokarbonlar – ARENES
- Aromatik hidrokarbonları tanımlar.
- Neden aromatik olarak adlandırılıyorlar?
- Aromatik hidrokarbonların tipik bir temsilcisi...?
- Kimlerin isimleri benzenin kökeniyle ilişkilidir?
- Benzenin moleküler formülü nedir?
- Benzenin kaç yapısal formülü var?
- Hibritleşme türü?
- Benzen molekülünde hangi bağlar vardır ve kaç tane?
- Aromatik hidrokarbonların en önemli kaynakları nelerdir?
- Diğer elde etme yöntemleri?
- Benzen hamloglarını adlandırın.
- Benzen molekülünün yapısı (öğrenci mesajı). (Slayt 4).
- Öğrencilerin bağımsız çalışmaları (5-7 dakika boyunca). (Slayt 5).
- aromatik hidrokarbonların tanımındaki boşlukları doldurun;
- verilen maddelerin formüllerini yazın;
- aromatik hidrokarbonlar üreten reaksiyonların indirgenmesini tamamlar.
III. Yeni materyal öğrenme.
1. Benzenin fiziksel özellikleri. (Slayt 6).
Benzen, hoş olmayan bir kokuya sahip, renksiz, uçucu, yanıcı bir sıvıdır. Sudan hafiftir (=0,88 g/cm3) ve su ile karışmaz ancak organik çözücülerde çözünür ve birçok maddeyi iyi çözer. Benzen 80,1 C'de kaynar; soğutulduğunda kolayca beyaz kristal bir kütle halinde katılaşır. Benzen ve buharları zehirlidir. Buharlarının sistematik olarak solunması anemi ve lösemiye neden olur.
– Video materyali (benzenin fiziksel özellikleri).
2. Benzenin kimyasal özellikleri.
1) Benzenin kimyasal özellikleri molekülünün yapısına göre belirlenir.
2) Aromatik sistemin stabilitesi arttırılmıştır.
3) Bu nedenle benzen doymamış bir hidrokarbon olmasına rağmen doymuş hidrokarbonların özelliklerini gösterir (ikame reaksiyonlarına yatkınlık, oksitleyici maddelere karşı direnç).
Yer değiştirme reaksiyonları.

İlave reaksiyonları (Slayt 9).
Belirli koşullar altında benzen de katılma reaksiyonlarına girebilir. Bu reaksiyonlarda aromatik sistem bozulduğu için bunların oluşması için zorlu koşullar gerekmektedir.

Oksidasyon reaksiyonları. (Slayt 10).
a) benzenin bromlu suya ve potasyum permanganata oranı (video materyali)
b) benzenin yanması
2C 6 H 6 + 15O 2 –> 2CO 2 + 6H 2 O
IV. Konsolidasyon.
(Slayt 11).- Benzen setteki her maddeyle reaksiyona girer:
a) Br 2, O 2, KMnO 4
b) H 2 O, HNO 3, CI 2
c) CI 2, O 2, HNO 3
d) HCI, Br 2, H 2
Benzenin bu setteki maddelerle reaksiyonları için denklemleri yazın, bunların oluşma koşullarını belirtin.
V. Ödev.
Maddeleri tanımlayın X,Y,Z dönüşüm şemasında:
Edebiyat:
- Rudzitis G.E., Feldman F.G. Organik kimya: Genel eğitim kurumlarının 10. sınıfları için ders kitabı. – 8. baskı. – M.: Eğitim, 2002.
- Novoshinsky I.I., Novoshinskaya N.S. Organik kimya. 11. sınıf: Genel eğitim kurumları için ders kitabı. – M.: “Eğitim” Yayınevi, 2005.
Bayan Khimiya nihayet ve geri dönülemez bir şekilde benzen gibi bir bileşiği ancak 1833'te elde etti. Benzen, çabuk öfkelenen, hatta patlayıcı bile diyebileceğimiz bir karaktere sahip bir bileşiktir. Nasıl öğrendin?
Hikaye
1649'da Johann Glauber dikkatini bir kimyagerin kömür katranını işlerken başarılı bir şekilde oluşan bir bileşiğe çevirdi. Ancak gizli kalmayı tercih etti.
Yaklaşık 170 yıl sonra, daha doğrusu 19. yüzyılın yirmili yaşlarının ortalarında, tesadüfen benzen, aydınlatıcı gazdan, yani açığa çıkan yoğuşmadan elde edildi. İnsanlık bu çabalarını İngiltere'den bilim adamı Michael Faraday'a borçludur.
Benzen elde etme görevi Alman Eilgard Mitscherlich tarafından devralındı. Bu, benzoik asidin susuz kalsiyum tuzlarının işlenmesi sırasında meydana geldi. Belki de bileşiğe böyle bir isim verilmesinin nedeni budur - benzen. Alternatif olarak bilim adamı buna benzin adını verdi. Tütsü, eğer Arapçadan çevrilmişse.
Benzen güzel ve parlak bir şekilde yanıyor; bu gözlemlerle bağlantılı olarak Auguste Laurent ona "fen" veya "benzen" adını vermeyi önerdi. Parlak, ışıltılı - eğer Yunancadan çevrilmişse.
Bilim adamı, elektronik iletişimin doğası ve benzenin nitelikleri kavramına dayanarak bileşiğin molekülünü aşağıdaki görüntü biçiminde sağladı. Bu bir altıgen. İçinde bir daire yazılıdır. Yukarıdakiler, benzenin, döngünün altı (istisnasız) karbon atomunu güvenli bir şekilde çevreleyen tam bir elektron bulutuna sahip olduğunu göstermektedir. Bağlı ikili bağ gözlenmez.
Benzen daha önce çözücü olarak kullanılıyordu. Ama temelde, dedikleri gibi, üye değildi, katılmadı, karışmadı. Ancak bu 19. yüzyılda. 20. yüzyılda önemli değişiklikler yaşandı. Benzenin özellikleri, onun daha popüler olmasına yardımcı olan en değerli nitelikleri ifade eder. Yüksek olduğu ortaya çıkan oktan sayısı, arabalara yakıt ikmali için yakıt unsuru olarak kullanılmasını mümkün kıldı. Bu eylem, benzenin kapsamlı bir şekilde geri çekilmesine ivme kazandırdı; bunun çıkarılması, koklaşabilir çelik üretiminde ikincil bir ürün olarak gerçekleştiriliyor.
Kırklı yıllarda benzen kimya alanında hızla patlayan maddelerin üretiminde kullanılmaya başlandı. 20. yüzyıl, petrol rafineri endüstrisinin kimya endüstrisine tedarik sağlayacak kadar çok benzen üretmesiyle taçlandı.
Benzenin özellikleri
Doymamış hidrokarbonlar benzene çok benzer. Örneğin etilen hidrokarbon serisi kendisini doymamış bir hidrokarbon olarak nitelendirmektedir. Bir ekleme reaksiyonu ile karakterize edilir. Benzen aynı düzlemde bulunan atomlar sayesinde tüm bunların içine rahatlıkla girmektedir. Ve aslında eşlenik bir elektron bulutu.

Formülde bir benzen halkası mevcutsa, yapısal formülü tam olarak buna benzeyen benzen olduğu temel sonucuna varabiliriz.
Fiziksel özellikler
Benzen, rengi olmayan ancak hoş olmayan bir kokusu olan bir sıvıdır. Benzen, sıcaklık 5,52 santigrat dereceye ulaştığında erir. 80.1'de kaynar. Yoğunluk 0,879 g/cm3, molar kütle 78,11 g/mol'dür. Yanarken çok duman çıkarıyor. Hava girdiğinde patlayıcı bileşikler oluşturur. kayalar (benzin, eter ve diğerleri) açıklanan maddeyle sorunsuz bir şekilde birleşir. Su ile azeotropik bir bileşik oluşturur. Buharlaşmadan önce ısıtma 69,25 derecede (%91 benzen) başlar. 25 santigrat derecede suda 1,79 g/l çözünebilir.
Kimyasal özellikler
Benzen sülfürik ve nitrik asitle reaksiyona girer. Ve ayrıca alkenler, halojenler, kloroalkanlar ile. İkame reaksiyonu onun karakteristik özelliğidir. Basınç sıcaklığı, oldukça zorlu koşullar altında meydana gelen benzen halkasının kırılmasını etkiler.
Her benzen reaksiyon denklemini daha ayrıntılı olarak ele alabiliriz.
1. Elektrofilik ikame. Brom, bir katalizör varlığında klor ile reaksiyona girer. Sonuç olarak klorobenzen elde ederiz:
С6H6+3Cl2 → C6H5Cl + HC1
2. Friedel-Crafts reaksiyonu veya benzenin alkilasyonu. Alkilbenzenlerin görünümü, halojen türevleri olan alkanlarla kombinasyon nedeniyle ortaya çıkar:
C6H6 + C2H5Br → C6H5C2H5 + HBr
3. Elektrofilik ikame. Burada nitrasyon ve sülfonasyon reaksiyonu gerçekleşir. Benzen denklemi şöyle görünecektir:
C6H6 + H2SO4 → C6H5SO3H + H2O
C6H6 + HNO3 → C6H5NO2 + H2O
4. Yanarken benzen:
2C6H6 + 15O2 → 12CO2 + 6H2O
Belirli koşullar altında doymuş hidrokarbonların karakter özelliğini sergiler. Söz konusu maddenin yapısında yer alan P-elektron bulutu bu reaksiyonları açıklamaktadır.
Farklı benzen türleri özel teknolojiye bağlıdır. Petrol benzeninin etiketlendiği yer burasıdır. Örneğin sentez için saflaştırılmış ve yüksek oranda saflaştırılmış. Benzen homologlarını ve daha spesifik olarak bunların kimyasal özelliklerini ayrı ayrı belirtmek isterim. Bunlar alkilbenzenlerdir.

Benzen homologları çok daha kolay tepki verir. Ancak benzenin yani homologların yukarıdaki reaksiyonları bazı farklılıklarla gerçekleşir.
Alkilbenzenlerin halojenasyonu
Denklemin formu aşağıdaki gibidir:
C6H5-CH3 + Br = C6H5-CH2Br + HBr.
Bromun benzen halkasına eğilimi gözlenmez. Yandan zincire çıkıyor. Ancak Al(+3) tuzu katalizörü sayesinde brom halkaya kolaylıkla girer.
Alkilbenzenlerin nitrasyonu
Sülfürik ve nitrik asitler sayesinde benzenler ve alkilbenzenler nitratlanır. Reaktif alkilbenzenler. Sunulan üç üründen ikisi elde edildi - bunlar para ve orto-izomerlerdir. Formüllerden birini yazabilirsiniz:
C6H5 - CH3 + 3HNO3 → C6H2CH3 (NO2)3.
Oksidasyon
Benzen için bu kabul edilemez. Ancak alkilbenzenler kolaylıkla reaksiyona girer. Örneğin benzoik asit. Formül aşağıda verilmiştir:
C6H5CH3 + [O] → C6H5COOH.
Alkilbenzen ve benzen, hidrojenasyonları
Bir amplifikatörün varlığında, hidrojen benzenle reaksiyona girmeye başlar ve yukarıda tartışıldığı gibi sikloheksan oluşumuyla sonuçlanır. Benzer şekilde alkilbenzenler de kolaylıkla alkilsikloheksanlara dönüştürülür. Alkilsikloheksan elde etmek için istenen alkilbenzenin hidrojenlenmesi gerekir. Bu temel olarak saf bir ürün üretmek için gerekli bir prosedürdür. Ve bunlar benzen ve alkilbenzenin tüm reaksiyonları değil.
Benzen üretimi. Endüstri
Bu tür bir üretimin temeli, bileşenlerin işlenmesine dayanmaktadır: toluen, nafta, kömürün parçalanması sırasında açığa çıkan katran ve diğerleri. Bu nedenle petrokimya ve metalurji işletmelerinde benzen üretilmektedir. Farklı saflık derecelerinde benzenin nasıl elde edileceğini bilmek önemlidir, çünkü üretim prensibi ve amacı doğrudan bu maddenin markasına bağlıdır.
Aslan payı, kostobiyolit kısmının termokatalitik olarak yeniden şekillendirilmesi, 65 derecede kaynatılması, ekstrakt etkisi yapılması, dimetilformamid ile damıtılmasıyla üretilir.
Etilen ve propilen üretilirken, inorganik ve organik bileşiklerin ısının etkisi altında ayrışması sırasında oluşan sıvı ürünler elde edilir. Benzen onlardan izole edilir. Ancak ne yazık ki benzen ekstraksiyonuna yönelik bu seçenek için çok fazla kaynak malzeme yok. Bu nedenle ilgilendiğimiz madde ıslah edilerek elde edilir. Bu yöntemle benzenin hacmi arttırılır.

610-830 derece sıcaklıkta, artı işaretli, su ve hidrojenin kaynatılmasıyla oluşan buhar varlığında alkilasyon yoluyla toluenden benzen elde edilir. Başka bir seçenek daha var - katalitik. Zeolitlerin veya alternatif olarak oksit katalizörlerin varlığı gözlemlendiğinde, 227-627 derecelik bir sıcaklık rejimine tabidir.
Benzen geliştirmek için daha eski bir yöntem daha var. Organik kökenli emiciler tarafından emilmesi sayesinde koklaşabilir taş kömürünün nihai sonucundan izole edilir. Ürün bir buhar-gaz ürünüdür ve önceden soğutulmuştur. Örneğin kaynağı petrol veya kömür olan petrol kullanılır. Buharla damıtma yapıldığında emici ayrılır. Hidro-işlem ham benzenden fazla maddenin uzaklaştırılmasına yardımcı olur.
Kömür hammaddeleri
Metalurjide kömür kullanıldığında veya daha doğrusu kuru damıtılarak kok elde edilir. Bu prosedür sırasında hava beslemesi sınırlıdır. Kömürün 1200-1500 santigrat sıcaklığa kadar ısıtıldığını unutmayın.
Kömür kimyasal benzenin kapsamlı bir saflaştırmaya ihtiyacı vardır. Metil sikloheksan ve arkadaşı n-heptandan kurtulmak zorunludur. da el konulmalıdır. Benzen, birden fazla kez gerçekleştirilecek bir ayırma ve saflaştırma işlemiyle karşı karşıyadır.
Yukarıda anlatılan yöntem en eskisidir ancak zamanla yüksek konumunu kaybeder.
Yağ fraksiyonları
%0,3-1,2 - bunlar kahramanımızın ham petroldeki bileşim göstergeleridir. Para ve çaba yatırımı için yetersiz göstergeler. Petrol fraksiyonlarının işlenmesi için endüstriyel bir prosedür kullanmak en iyisidir. Yani katalitik reformasyon. Bir alüminyum-platin-renyum amplifikatörünün varlığında aromatik karbonhidratların yüzdesi artar ve yakıtın sıkıştırılması sırasında kendiliğinden tutuşmama yeteneğini belirleyen gösterge artar.
Piroliz reçineleri
Petrol ürünümüzü katı olmayan hammaddelerden, yani üretim sırasında ortaya çıkan propilen ve etilenin pirolizi yoluyla çıkarırsak, bu yaklaşım en kabul edilebilir olacaktır. Daha kesin olmak gerekirse pirokondensattan benzen salınır. Belirli oranların ayrışması hidro-işlem gerektirir. Temizleme sırasında kükürt ve doymamış karışımlar uzaklaştırılır. İlk sonuç ksilen, toluen ve benzeni içeriyordu. Ekstraktif bir yöntem olan damıtma kullanılarak BTK grubu ayrıştırılarak benzen üretilir.

Toluenin hidrodealkilasyonu
Prosesin ana karakterleri olan hidrojen akışı ve toluenden oluşan bir kokteyl, reaktöre ısıtılarak beslenir. Toluen katalizör yatağından geçer. Bu işlem sırasında metil grubu benzen oluşturmak üzere ayrılır. Burada belirli bir temizleme yöntemi uygundur. Sonuç oldukça saf bir maddedir (nitrasyon için).
Toluenin orantısızlığı
Metil sınıfının reddedilmesi sonucunda benzen oluşumu meydana gelir ve ksilen oksitlenir. Bu süreçte transalkilasyon gözlemlenmiştir. Katalitik etki, alüminyum oksit üzerinde bulunan paladyum, platin ve neodim sayesinde ortaya çıkar.
Taluen ve hidrojen reaktöre stabil bir katalizör yatağıyla sağlanır. Amacı hidrokarbonların katalizör düzlemine yerleşmesini önlemektir. Reaktörden çıkan akım soğutulur ve hidrojen, geri dönüşüm için güvenli bir şekilde geri kazanılır. Geriye kalan üç kez damıtılır. İlk aşamada aromatik olmayan bileşikler uzaklaştırılır. Benzen ikinci olarak ekstrakte edilir ve son adım ksilenlerin ayrılmasıdır.
Asetilen trimerizasyonu
Fransız fizikokimyacı Marcelin Berthelot'un çalışmaları sayesinde asetilenden benzen üretilmeye başlandı. Ancak göze çarpan şey, diğer birçok unsurun yoğun bir kokteyliydi. Sorun reaksiyon sıcaklığının nasıl düşürüleceğiydi. Cevap ancak 20. yüzyılın kırklı yıllarının sonlarında alındı. V. Reppe uygun katalizörü buldu ve bunun nikel olduğu ortaya çıktı. Asetilenden benzen elde etmenin tek yolu trimerizasyondur.

Benzen aktif karbon kullanılarak oluşturulur. Yüksek ısı seviyelerinde asetilen kömürün üzerinden geçer. Sıcaklık en az 410 derece ise benzen açığa çıkar. Aynı zamanda çeşitli aromatik hidrokarbonlar da doğar. Bu nedenle asetileni verimli bir şekilde temizleyebilecek iyi ekipmanlara ihtiyacınız var. Trimerizasyon gibi emek yoğun bir yöntemle çok fazla asetilen tüketilir. 15 ml benzen elde etmek için 20 litre asetilen alın. Nasıl göründüğünü görebilirsiniz ve tepki uzun sürmez.
3C2H2 → C6H6 (Zelinsky denklemi).
3CH → CH = (t, kat) = C6H6.
Benzen nerede kullanılır?
Benzen kimyanın oldukça popüler bir buluşudur. Özellikle benzenin kümen, sikloheksan ve etilbenzen üretiminde nasıl kullanıldığı fark edildi. Stiren oluşturmak için etilbenzen olmadan yapamazsınız. Kaprolaktam üretimi için başlangıç malzemesi sikloheksandır. Termoplastik reçine yapılırken kaprolaktam kullanılır. Açıklanan madde, çeşitli boya ve verniklerin üretiminde vazgeçilmezdir.
Benzen ne kadar tehlikelidir?
Benzen zehirli bir maddedir. Mide bulantısı ve şiddetli baş dönmesinin eşlik ettiği halsizlik hissinin ortaya çıkması zehirlenme belirtisidir. Ölüm bile göz ardı edilemez. Tarif edilemez bir zevk hissi, benzen zehirlenmesi için daha az endişe verici çanlar değildir.
Sıvı formdaki benzen ciltte tahrişe neden olur. Benzen buharları sağlam cilde bile kolayca nüfuz eder. Küçük bir dozda, ancak düzenli olarak maddeyle çok kısa süreli temaslarda, hoş olmayan sonuçların gelmesi uzun sürmeyecektir. Bu kemik iliği hasarı ve çeşitli tiplerde akut lösemi olabilir.

Ayrıca madde insanlarda bağımlılığa neden oluyor. Benzen uyuşturucu gibi davranır. Tütün dumanı katran benzeri bir ürün üretir. Üzerinde çalıştıklarında içeriğinin insanlar için güvenli olmadığı sonucuna vardılar. Nikotinin varlığına ek olarak benzpiren gibi aromatik karbonhidratların varlığı da keşfedildi. Benzopirenin ayırt edici özelliği kanserojen olmasıdır. Çok zararlı etkileri var. Mesela kansere sebep oluyorlar.
Yukarıdakilere rağmen benzen, çeşitli ilaçların, plastiklerin, sentetik kauçukların ve tabii ki boyaların üretimi için başlangıç hammaddesidir. Bu, kimyanın ve aromatik bir bileşiğin en yaygın buluşudur.
Benzenin döngüsel yapısı ilk olarak F.A. 1865 yılında Kekule

Friedrich August Kekule von Stradonitz - 19. yüzyılın seçkin bir Alman kimyacısı. 1854 yılında kükürt içeren ilk organik bileşiği - tiyoasetik asit (tiyoetanoik asit) keşfetti. Ayrıca diazo bileşiklerinin yapısını da kurdu. Ancak kimyanın gelişimine en ünlü katkısı benzenin yapısını ortaya koymasıdır (1866). Kekulé, benzenin çift bağlarının halka etrafında değiştiğini gösterdi (bu fikir ilk kez rüyasında aklına geldi). Daha sonra olası iki çift bağ düzenlemesinin aynı olduğunu ve benzen halkasının iki yapı arasında bir melez olduğunu gösterdi. Böylece 1930'ların başında kimyasal bağlanma teorisinde ortaya çıkan rezonans (mezomerizm) fikrini öngördü.
Eğer benzen gerçekten böyle bir yapıya sahip olsaydı, 1,2-disübstitüe edilmiş türevlerinin iki izomeri olması gerekirdi. Örneğin,

Ancak 1,2-disübstitüe benzenlerin hiçbiri iki izomer halinde izole edilemez.
Bu nedenle Kekule daha sonra benzen molekülünün birbirine hızla dönüşen iki yapı halinde var olduğunu öne sürdü:

Benzen molekülleri ve türevlerinin bu tür şematik gösterimlerinin genellikle benzen halkasının karbon atomlarına bağlı hidrojen atomlarını göstermediğine dikkat edin.
Modern kimyada benzen molekülü, bu iki sınırlayıcı rezonans formunun rezonans melezi olarak kabul edilir (bkz. Bölüm 2.1). Benzen molekülünün başka bir açıklaması, moleküler yörüngelerinin dikkate alınmasına dayanmaktadır. Böcek. Şekil 3.1'de, -bağlanma yörüngelerinde bulunan -elektronların, benzen halkasının tüm karbon atomları arasında yer değiştirdiği ve bir -elektron bulutu oluşturduğu belirtilmiştir. Bu gösterime uygun olarak benzen molekülü geleneksel olarak aşağıdaki gibi gösterilebilir:
Deneysel veriler benzende böyle bir yapının varlığını doğrulamaktadır. Eğer benzen, Kekulé'nin başlangıçta önerdiği üç konjuge çift bağ içeren yapıya sahip olsaydı, o zaman benzenin alkenler gibi katılma reaksiyonlarına girmesi gerekirdi. Ancak yukarıda da belirtildiği gibi benzen katılma reaksiyonlarına girmez. Ayrıca benzen, üç izole edilmiş çift bağa sahip olduğu duruma göre daha kararlıdır. Böcek. Şekil 5.3'te sikloheksan oluşturmak için benzen hidrojenasyonunun entalpisinin daha büyük bir negatif olduğu belirtilmiştir.
Tablo 18.3. Çeşitli karbon-karbon bağlarının uzunluğu


Pirinç. 18.6. Benzen molekülünün geometrik yapısı.
sikloheksenin hidrojenasyon entalpisinin üç katından fazla değer. Bu miktarlar arasındaki farka genellikle benzenin delokalizasyon entalpisi, rezonans enerjisi veya stabilizasyon enerjisi denir.
Benzen halkasındaki tüm karbon-karbon bağları aynı uzunluğa sahiptir; bu, alkanlardaki C-C bağlarının uzunluğundan daha kısa, ancak alkenlerdeki C=C bağlarının uzunluğundan daha uzundur (Tablo 18.3). Bu, benzendeki karbon-karbon bağlarının tek ve çift bağlar arasında bir melez olduğunu doğrular.
Benzen molekülü, Şekil 2'de gösterilen düz bir yapıya sahiptir. 18.6.
Fiziksel özellikler
Benzen normal koşullar altında 5,5 °C'de donup 80 °C'de kaynayan renksiz bir sıvıdır. Karakteristik hoş bir kokusu vardır, ancak yukarıda belirtildiği gibi oldukça zehirlidir. Benzen suyla karışmaz ve benzen sisteminde iki katmanın üst kısmını su oluşturur. Bununla birlikte, polar olmayan organik çözücülerde çözünür ve kendisi de diğer organik bileşikler için iyi bir çözücüdür.
Kimyasal özellikler
Benzen belirli katılma reaksiyonlarına maruz kalmasına rağmen (aşağıya bakınız), alkenlere özgü reaktiviteyi göstermez. Örneğin bromlu suyun veya iyon çözeltisinin rengini bozmaz. Üstelik benzen
hidroklorik veya sülfürik asit gibi kuvvetli asitlerle katılma reaksiyonlarına girer.
Aynı zamanda benzen bir takım elektrofilik ikame reaksiyonlarında da yer alır. Bu tür reaksiyonların ürünleri aromatik bileşiklerdir, çünkü bu reaksiyonlarda benzenin delokalize elektronik sistemi korunur. Benzen halkasındaki bir hidrojen atomunun bir elektrofil ile değiştirilmesine ilişkin genel mekanizma Bölüm'de anlatılmıştır. 17.3. Benzenin elektrofilik ikamesinin örnekleri nitrasyonu, halojenasyonu, sülfonasyonu ve Friedel-Crafts reaksiyonlarıdır.
Nitrasyon. Benzen, konsantre nitrik ve sülfürik asitlerin bir karışımı ile işlenerek nitratlanabilir (kendisine eklenen bir grup):

nitrobenzen
Bu reaksiyonun koşulları ve mekanizması bölümde anlatılmıştır. 17.3.
Nitrobenzen, karakteristik badem kokusuna sahip soluk sarı bir sıvıdır. Benzen nitratlandığında nitrobenzene ek olarak aşağıdaki reaksiyonun ürünü olan 1,3-dinitrobenzen kristalleri de oluşur:

Halojenasyon. Benzeni karanlıkta klor veya bromla karıştırırsanız hiçbir reaksiyon oluşmaz. Ancak Lewis asitlerinin özelliklerini taşıyan katalizörlerin varlığında bu tür karışımlarda elektrofilik yer değiştirme reaksiyonları meydana gelir. Bu reaksiyonlar için tipik katalizörler demir(III) bromür ve alüminyum klorürdür. Bu katalizörlerin etkisi, halojen moleküllerinde polarizasyon yaratmaları ve daha sonra katalizörle bir kompleks oluşturmalarıdır:
ancak bu durumda serbest iyonların oluştuğuna dair doğrudan bir kanıt yoktur. İyon taşıyıcı olarak demir (III) bromürün kullanıldığı benzen brominasyon mekanizması aşağıdaki gibi temsil edilebilir:

Sülfonasyon. Benzen, karışımının konsantre sülfürik asit ile birkaç saat boyunca geri akıtılmasıyla sülfonatlanabilir (bir hidrojen atomunu bir sülfo grubuyla değiştirin). Bunun yerine benzen, dumanlı sülfürik asitle karıştırılarak dikkatlice ısıtılabilir. Dumanlı sülfürik asit, sülfür trioksit içerir. Bu reaksiyonun mekanizması diyagramla gösterilebilir

Friedel-Crafts reaksiyonları. Friedel-Crafts reaksiyonları başlangıçta, susuz bir alüminyum klorür katalizörünün varlığında aromatik bileşikler ve alkil halojenürler arasındaki yoğunlaşma reaksiyonları olarak adlandırılıyordu.
Yoğunlaşma reaksiyonlarında, iki reaktif molekülü (veya bir reaktif) birbirleriyle birleşerek yeni bir bileşik molekülü oluştururken, su veya hidrojen klorür gibi bazı basit bileşiklerin bir molekülü bunlardan ayrılır (ortadan kaldırılır).
Şu anda, Friedel-Crafts reaksiyonuna, bir elektrofilin rolünün bir karbokatyon veya pozitif yüklü bir karbon atomuna sahip yüksek derecede polarize bir kompleks tarafından oynandığı aromatik bir bileşiğin herhangi bir elektrofilik ikamesi adı verilmektedir. Elektrofilik madde, kural olarak, bir alken veya bir alkol de olabilmesine rağmen, bir karboksilik asitin alkil halojenürü veya klorürüdür. Susuz alüminyum klorür genellikle bu reaksiyonlar için katalizör olarak kullanılır. Friedel-Crafts reaksiyonları genellikle iki türe ayrılır: alkilasyon ve asilasyon.
Alkilasyon. Bu tip Friedel-Crafts reaksiyonunda benzen halkasındaki bir veya daha fazla hidrojen atomunun yerini alkil grupları alır. Örneğin benzen ve klorometan karışımı susuz alüminyum klorür varlığında hafifçe ısıtıldığında metilbenzen oluşur. Klorometan bu reaksiyonda elektrofilik bir ajanın rolünü oynar. Halojen moleküllerinde olduğu gibi alüminyum klorür tarafından polarize edilir:
Söz konusu reaksiyonun mekanizması aşağıdaki gibi sunulabilir:

Benzen ve klorometan arasındaki bu yoğunlaşma reaksiyonunda bir hidrojen klorür molekülünün elimine edildiğine dikkat edilmelidir. Ayrıca metal karbokatyonun serbest iyon formundaki gerçek varlığının şüpheli olduğunu da unutmayın.
Benzenin, bir katalizör - susuz alüminyum klorür varlığında klorometan ile alkilasyonu, metilbenzen oluşumuyla sonuçlanmaz. Bu reaksiyonda benzen halkasının daha fazla alkilasyonu meydana gelir ve bu da 1,2-dimetilbenzenin oluşumuna yol açar:

Asilasyon. Bu tip Friedel-Crafts reaksiyonunda benzen halkasındaki bir hidrojen atomunun yerini bir asil grubu alır ve bunun sonucunda aromatik bir keton oluşur.
Asil grubu genel formüle sahiptir
Bir asil bileşiğinin sistematik adı, bu asil bileşiğinin bir türevi olduğu karşılık gelen karboksilik asit adındaki -ova son ekinin -(o)il son ekiyle değiştirilmesiyle oluşturulur. Örneğin

Benzenin asilasyonu, susuz alüminyum klorür olan bir katalizör varlığında herhangi bir karboksilik asidin klorürü veya anhidriti kullanılarak gerçekleştirilir. Örneğin

Bu reaksiyon, bir hidrojen klorür molekülünün elimine edildiği bir yoğunlaşmadır. Ayrıca "fenil" adının genellikle benzenin ana grup olmadığı bileşiklerdeki benzen halkasına atıfta bulunmak için kullanıldığına dikkat edin:

İlave reaksiyonları. Benzen en çok elektrofilik ikame reaksiyonları ile karakterize edilmesine rağmen, aynı zamanda bazı katılma reaksiyonlarına da uğrar. Bunlardan biriyle zaten tanışmıştık. Benzenin hidrojenasyonundan bahsediyoruz (bkz. bölüm 5.3). Benzen ve hidrojenden oluşan bir karışım, 150-160 °C sıcaklıkta ince öğütülmüş bir nikel katalizörünün yüzeyinden geçirildiğinde, sikloheksan oluşumuyla sonuçlanan bir dizi reaksiyon meydana gelir. Bu reaksiyonun genel stokiyometrik denklemi aşağıdaki gibi temsil edilebilir:

Benzen, ultraviyole radyasyona veya doğrudan güneş ışığına maruz kaldığında klorla da reaksiyona girer. Bu reaksiyon karmaşık bir radikal mekanizma yoluyla gerçekleşir. Nihai ürünü 1,2,3,4,5,6-hekzaklorosikloheksandır:

Benzer bir reaksiyon, ultraviyole radyasyonun veya güneş ışığının etkisi altında benzen ve brom arasında meydana gelir.
Oksidasyon. Benzen ve diğer aromatik bileşiklerdeki benzen halkası, genel olarak konuşursak, potasyum permanganatın asidik veya alkalin çözeltisi gibi güçlü oksitleyici maddelerle bile oksidasyona karşı dirençlidir. Bununla birlikte, benzen ve diğer aromatik bileşikler hava veya oksijende yanarak çok dumanlı bir alev üretirler; bu, yüksek bağıl karbon içeriğine sahip hidrokarbonların tipik bir örneğidir.

Benzen homologları, reaktifin doğasına bağlı olarak bir aromatik çekirdek ve bir yan zincirin (alkil grupları) katılımıyla iki yönde reaksiyona girebilir.
1. Aromatik halkadaki reaksiyonlar
Alkil grubunun donör etkisinden dolayı S E ArH reaksiyonları şu şekilde ilerler: orto- Ve çift- aromatik halkanın konumu, koşullar ise benzene göre daha ılımandır.
a) halojenasyon

b) nitrasyon


Alıcı grupların (-NO2) sayısı arttıkça nitrasyon reaksiyonlarının sıcaklığının nasıl arttığına dikkat edin.
c) sülfonasyon

Reaksiyon ağırlıklı olarak üretir N-izomer.
d) alkilasyon

e) asilasyon

2. Yan zincir reaksiyonları
Benzen molekülünün alkil fragmanı, karbon atomunu içeren SR reaksiyonlarına girer. α -pozisyon (benzilik pozisyon).


Tüm benzen homologlarının KMnO4 /100°C ile oksidasyonu benzoik asit oluşumuna yol açar.
Yoğunlaştırılmış arenalar

Yoğunlaştırılmış arenler aromatik sistemlerdir (n=2 ve 3). Yoğunlaştırılmış arenlerin aromatiklik derecesi benzenden daha düşüktür. Benzenden daha ılıman koşullar altında meydana gelen elektrofilik ikame reaksiyonları, ekleme reaksiyonları ve oksidasyon reaksiyonları ile karakterize edilirler.
Naftalinin reaktivitesi
Naftalin için S E ArH reaksiyonları esas olarak şu şekilde ilerler: α -pozisyonu, sülfonasyon hariç. Ad E'nin elektrofilik eklenmesi 1,4 pozisyonunda meydana gelir ve naftalin, konjuge dienlerin özelliklerini sergiler.
1. Elektrofilik ikame reaksiyonları,S e ArH


2. Elektrofilik katılma, indirgeme ve oksidasyon reaksiyonları.


Antrasen ve fenantrenin reaktivitesi
Antrasen için elektrofilik ikame, S E ArH ve elektrofilik ekleme, Ad E reaksiyonları ağırlıklı olarak 9 ve 10 pozisyonlarında meydana gelir (aşağıdaki şemaya bakınız).

Fenantren için elektrofilik ikame, S E ArH ve elektrofilik ekleme, Ad E reaksiyonları, antrasen için olduğu gibi ağırlıklı olarak 9 ve 10 pozisyonlarında meydana gelir (aşağıdaki şemaya bakınız).

Antrasen ve fenantren için oksidasyon ve redüksiyon reaksiyonları.


Naftalin bazlı bazı ilaçların yapıları, antrasen ve fenantren
Naftizin(nafazolin, sanorin)

vazokonstriktör etkisi(rinit, sinüzit tedavisi)
(başlıkta orijinal yapı vurgulanmıştır, numaralandırmaya dikkat ediniz)
Naftifin

mantar önleyici eylem (dermatit tedavisi)
Nabumeton

antiinflamatuar, antipiretik, analjezik etki(osteoartrit, romatoid artrit tedavisi).
Nadolol

(cis terimi bu durumda hidroksil gruplarının göreceli konumunu belirtir)
hipotansif(tansiyonu düşürür) ve antiaritmik etki
Morfin, kodein

“ARENALAR” bölümü için test soruları
1. Benzenin hangi özellikleri onu diğer doymamış bileşiklerden (alkenler, alkinler) ayırır? “Aromatik bileşik” terimi ne anlama geliyor?
2. Bileşiklerin yapısal formüllerini yazın: a) etilbenzen; b) 1,3-dimetilbenzen ( M -ksilen); c) 1,3,5-trimetilbenzen (mesitilen); d) izopropilbenzen (kümen); e) 3-fenilpentan; f) vinilbenzen (stiren); g) fenilasetilen; H) trans -difeniletilen ( trans -stilben).
3. Aromatiklik gösteren bileşiklerin yapısal özelliklerini tanımlayabilecektir. Hückel kuralını formüle edin. Aşağıdaki bileşiklerden hangisi aromatiktir?

4. Belirtilen koşullar altında sikloheksen ve benzenin oranını aşağıdaki reaktiflerle karşılaştırın : a) Kardeşim 2 (H 2 Ey, 20 C); b) KMnO 4 (H 2 O.0 C); c) N 2 BU YÜZDEN 4 (kons.), 20 C; d)H 2 (Pd, 30 C); Yapmak 3 , sonra H 2 O(Zn); f) HBr.
5. Benzenin aşağıdaki reaktiflerle reaksiyonunda oluşan tek ikameli benzenlerin yapısal formüllerini yazın: BİR 2 BU YÜZDEN 4 (kons.); b)HNO 3 ; N 2 BU YÜZDEN 4 (kons.); c) kardeşim 2 /Fe; d) Cl 2 /AlCl 3 ; e)CH 3 Br/AlBr 3 ; e)CH 3 COCl/AlСl 3 . Reaksiyonları ve ürünlerini adlandırın. Her özel durumda hangi elektrofil benzenin reaksiyona girdiğini belirtin.
6. Benzenin elektrofilik bir reaktifle etkileşimi için genel bir şema verin ( e + ). Ara kompleksleri adlandırın. Bir reaksiyonun hızını genellikle hangi adım belirler? Söz konusu reaksiyonun potansiyel enerjisindeki değişimi gösteren bir grafik verin.
7. Aşağıdaki kavramları tanımlayın: a) geçiş durumu; b) ara bağlantı; c) -kompleks; d)-kompleks. Hangileri birbirinin aynısı? Bir katalizör varlığında benzen brominasyonu örneğini kullanarak bu kavramları açıklayın. FeBr 3 .
8. Eten ve benzenin brom ile reaksiyonları örneğini kullanarak, alkenlerdeki elektrofilik katılma mekanizmasını aromatik serideki elektrofilik ikame mekanizmasıyla karşılaştırın. Fark hangi aşamada gözleniyor ve neden?
9. İndüktif ve mezomerik etkileri kullanarak, belirtilen bileşiklerdeki ikame edicinin benzen halkası ile etkileşimini tanımlayın:

Elektron veren (ED) ve elektron çeken (EA) ikame edicileri etiketleyin.
10. Bileşiklerin mononitrasyon şemalarını yazın: a) fenol; b) benzensülfonik asitler; c) izopropilbenzen; d) klorobenzen. Hangi bileşik için bağıl ikame oranı en yüksek olmalıdır ve neden?
11. Bileşiklerin monosülfonasyonu sırasında hangi ürünlerin oluşması beklenmelidir: a) toluen; b) nitrobenzen; c) benzoik asit; d) bromobenzen? Hangi bileşiğin en kolay sülfonatlanması gerekir? Neden?
12. Aşağıdaki bileşikleri bir benzen halkasına bromlarken artan reaktivite sırasına göre düzenleyin: a) benzen; b) fenol; c) benzaldehit; d) etilbenzen. Bir açıklama yapın.
13. Aşağıdaki hidrokarbonları adlandırın:

14. Benzenin aşağıdaki reaktiflerle reaksiyonlarını yazın : a) Cl 2 (Fe); b) 3Cl 2 (ışık); c)HNO 3 (H 2 BU YÜZDEN 4 ); Yapmak 2 (hava) (V 2 HAKKINDA 5 , 450 C); e) 3O 3 , sonra N 2 O(Zn); e)H 2 BU YÜZDEN 4 (oleum); 3H 2 (Hayır, 200 C,P ). Benzendeki katılma reaksiyonlarının özellikleri nelerdir?
15. Tolüenin belirtilen reaktiflerle reaksiyonlarını yazın : a) 3H 2 (Hayır, 200 C, 9806,7 kPa); b) KMnO 4 V N 2 HAKKINDA; c*)Cl 2 , ışık; d*)Cl 2 (Fe); e*) CH 3 Cl(AlCl 3 ); e*) CH 3 COCl (AlCl 3 ); g)HNO 3 (H 2 BU YÜZDEN 4 ). Yıldız işaretiyle işaretlenmiş reaksiyonlar için mekanizmaları belirtin.
16. Etilbenzenin nitrasyon reaksiyonlarını belirtilen koşullar altında yazın: a) %65 HNO3 3 +H 2 BU YÜZDEN 4 (kons.); b) %10 HNO3 3 , ısıtma, basınç. Mekanizmaları getirin.
17. İzopropilbenzenin broma oranını karşılaştırın: a) varlığında AlBr 3 ; b) aydınlatma ve ısıtma altında. Reaksiyonları ve mekanizmalarını veriniz.
18. Etilbenzenden hangi bileşikler oluşur ve N -belirtilen oksitleyici maddelerin etkisi altında ksilen: a) O 3 , sonra H 2 O(Zn); b) KMnO 4 H'de 2 HAKKINDA,T ; c)K 2 CR 2 O 7 H'de 2 BU YÜZDEN 4 , T ?
19. Aşağıdaki bileşik çiftleri hangi reaksiyonlarla ayırt edilebilir: a) etilbenzen ve M -ksilen; b) etilbenzen ve stiren; c) stiren ve fenilasetilen; G) O - Ve N -ksilenler mi?
20. Aşağıdaki reaksiyonların ürünleri hangi bileşiklerdir:

21. Benzen ve diğer reaktiflere dayanarak aşağıdaki bileşikleri elde edin: a) N -ovalar -butiltoluen; b) etil- N -tolil keton; c) alilbenzen; G) N -bromobenzoik asit.
22. Aşağıdaki reaksiyonlarda oluşan ana bileşikleri adlandırın:

Birinci grup reaksiyonlar ikame reaksiyonlarıdır. Arenlerin molekül yapısında birden fazla bağ bulunmadığını, ancak altı elektrondan oluşan konjuge bir sistem içerdiğini, bunun çok kararlı olduğunu ve benzen halkasına ek güç verdiğini söylemiştik. Bu nedenle kimyasal reaksiyonlarda benzen halkasının yok edilmesi değil, önce hidrojen atomlarının değiştirilmesi meydana gelir.
Alkanlardan bahsederken ikame reaksiyonlarıyla zaten karşılaştık, ancak onlar için bu reaksiyonlar radikal bir mekanizmayı takip ederken, arenler ikame reaksiyonlarının iyonik bir mekanizması ile karakterize edilir.
Birinci kimyasal özellik halojenasyon. Bir hidrojen atomunun halojen atomu, klor veya brom ile değiştirilmesi.
Reaksiyon ısıtıldığında ve her zaman bir katalizörün katılımıyla gerçekleşir. Klor durumunda alüminyum klorür veya ferrik klorür üç olabilir. Katalizör halojen molekülünü polarize ederek heterolitik bağ bölünmesine neden olur ve iyon üretir.
Klor pozitif yüklü bir iyondur ve benzen ile reaksiyona girer.
Reaksiyon brom ile meydana gelirse, katalizör demir bromür veya alüminyum bromürdür.

Reaksiyonun bromlu su ile değil moleküler bromlu olarak meydana geldiğini unutmamak önemlidir. Benzen bromlu su ile reaksiyona girmez.
Benzen homologlarının halojenlenmesinin kendine has özellikleri vardır. Toluen molekülünde metil grubu halkadaki yer değiştirmeyi kolaylaştırır, reaktivite artar ve reaksiyon daha ılıman koşullarda yani oda sıcaklığında gerçekleşir.

Yer değiştirmenin her zaman orto ve para pozisyonlarında meydana geldiğini, dolayısıyla bir izomer karışımı elde edildiğini unutmamak önemlidir.
Saniye benzenin nitrasyonu, benzen halkasına bir nitro grubunun eklenmesi.

Acı badem kokusuna sahip ağır sarımsı bir sıvı nitrobenzen oluşur, bu nedenle reaksiyon benzene göre nitel olabilir. Nitratlama için konsantre nitrik ve sülfürik asitlerin nitratlama karışımı kullanılır. Reaksiyon ısıtılarak gerçekleştirilir.
Konovalov reaksiyonunda alkanların nitrasyonu için sülfürik asit eklenmeden seyreltilmiş nitrik asit kullanıldığını hatırlatmama izin verin.
Toluenin nitrasyonu sırasında ve halojenasyon sırasında orto ve para izomerlerin bir karışımı oluşur.

Üçüncü Benzenin haloalkanlarla alkilasyonunun özelliği.

Bu reaksiyon, benzen halkasına bir hidrokarbon radikalinin dahil edilmesini sağlar ve benzen homologlarının üretilmesi için bir yöntem olarak düşünülebilir. Haloalkan molekülünün iyonlara ayrışmasını destekleyen bir katalizör olarak alüminyum klorür kullanılır. Isıtma da gereklidir.
Dördüncü Benzenin alkenlerle alkilasyonunun özelliği.

Bu şekilde örneğin kümen veya etilbenzen elde edebilirsiniz. Katalizör alüminyum klorür.
2. Benzene katılma reaksiyonları
İkinci grup reaksiyonlar ise katılma reaksiyonlarıdır. Bu reaksiyonların tipik olmadığını ancak oldukça sıkı koşullar altında pi-elektron bulutunun parçalanması ve altı sigma bağlarının oluşmasıyla mümkün olabileceğini söylemiştik.
Beşinci genel listedeki özellikler hidrojenasyon, hidrojen eklenmesi.
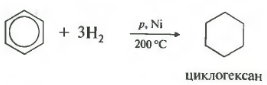
Sıcaklık, basınç, katalizör nikel veya platin. Toluen de aynı şekilde reaksiyona girebilir.
Altıncı mülkiyet klorlaması. Brom bu reaksiyona girmediğinden, özellikle klor ile etkileşimden bahsettiğimizi lütfen unutmayın.

Reaksiyon sert ultraviyole ışınımı altında meydana gelir. Bir katı olan heksakloranın diğer adı olan heksaklorosikloheksan oluşur.
Benzen için bunu hatırlamak önemlidir. mümkün değil hidrojen halojenürlerin katılma reaksiyonları (hidrohalojenasyon) ve suyun eklenmesi (hidrasyon).
3. Benzen homologlarının yan zincirindeki ikame
Üçüncü reaksiyon grubu yalnızca benzen homologlarıyla ilgilidir - bu, yan zincirdeki bir ikamedir.
Yedinci genel listedeki özellik, yan zincirdeki alfa karbon atomunda halojenasyondur.

Reaksiyon ısıtıldığında veya ışınlandığında ve her zaman yalnızca alfa karbonda meydana gelir. Halojenleşme devam ettikçe ikinci halojen atomu alfa konumuna geri dönecektir.
4. Benzen homologlarının oksidasyonu
Dördüncü reaksiyon grubu oksidasyondur.
Benzen halkası çok güçlü olduğundan benzen oksitlenmez potasyum permanganat çözeltisinin rengini bozmaz. Bunu hatırlamak çok önemlidir.
Ancak benzen homologları ısıtıldığında asitleştirilmiş bir potasyum permanganat çözeltisi tarafından oksitlenir. Ve bu sekizinci kimyasal özelliktir.

Bu benzoik asit üretir. Çözeltinin renginin değişmesi gözlenir. Bu durumda substituentin karbon zinciri ne kadar uzun olursa olsun daima ilk karbon atomundan sonra kırılır ve alfa atomu benzoik asit oluşumuyla karboksil grubuna oksitlenir. Molekülün geri kalanı karşılık gelen aside veya yalnızca bir karbon atomuysa karbondioksite oksitlenir.
Bir benzen homologunun aromatik halkada birden fazla hidrokarbon ikame edicisi varsa, oksidasyon aynı kurallara göre gerçekleşir: alfa pozisyonunda bulunan karbon oksitlenir.

Bu örnek, ftalik asit adı verilen dibazik aromatik asit üretir.
Kümenin, izopropilbenzenin, sülfürik asit varlığında atmosferik oksijen tarafından oksidasyonunu özellikle belirtmek isterim.

Bu, fenol üretmek için kümen yöntemi olarak adlandırılan yöntemdir. Kural olarak, fenol üretimi ile ilgili konularda bu reaksiyonla karşılaşılmaktadır. Bu endüstriyel bir yöntemdir.
Dokuzuncuözellik yanması, oksijenle tam oksidasyon. Benzen ve homologları yanarak karbondioksit ve suya dönüşür.
Benzenin yanma denklemini genel biçimde yazalım.
Kütlenin korunumu kanununa göre sağdaki atom sayısı kadar solda da atom bulunması gerekir. Çünkü kimyasal reaksiyonlarda atomlar kaybolmaz, ancak aralarındaki bağların sırası basitçe değişir. Molekül bir karbon atomu içerdiğinden, aren molekülünde karbon atomu sayısı kadar karbon dioksit molekülü olacaktır. Yani n CO2 molekülü. Hidrojen atomlarından iki kat daha az su molekülü yani (2n-6)/2 yani n-3 olacaktır.
Solda ve sağda aynı sayıda oksijen atomu vardır. Sağ tarafta karbondioksitten 2n var, çünkü her molekülde iki oksijen atomu var, artı sudan n-3, yani toplam 3n-3. Sol tarafta aynı sayıda 3n-3 oksijen atomu var, bu da molekülün iki kat daha az olduğu anlamına geliyor, çünkü molekül iki atom içeriyor. Yani (3n-3)/2 oksijen molekülüdür.
Böylece benzen homologlarının yanması için genel formda bir denklem derledik.