Hensikt og mål med leksjonen:
– systematisere studentenes kunnskap om strukturen til benzenmolekylet og metoder for fremstilling av det;
- danne en idé om de fysiske og kjemiske egenskapene til benzen, lære hvordan du komponerer ligninger av kjemiske reaksjoner som er karakteristiske for benzen;
– fortsette å utvikle elevenes ferdigheter i å arbeide med videomateriell og multimediapresentasjoner.
Arbeidsformer: frontal, individuell.
Utstyr: datamaskin, multimediaprojektor, "Benzol"-bord
I løpet av timene
I. Organisatorisk øyeblikk.
Lærer: Emne, mål og mål for leksjonen.
II. Aktivering av elevenes kunnskap.
- Frontalundersøkelse
- Aromatiske hydrokarboner – ARENES
- Definer aromatiske hydrokarboner.
- Hvorfor kalles de aromatiske?
- En typisk representant for aromatiske hydrokarboner er...?
- Hvem sine navn er assosiert med opprinnelsen til benzen?
- Hva er molekylformelen til benzen?
- Hvor mange strukturformler for benzen?
- Type hybridisering?
- Hvilke bindinger er det i et benzenmolekyl og hvor mange?
- Hva er de viktigste kildene til aromatiske hydrokarboner?
- Andre metoder for å skaffe?
- Nevn benzenhamlogene.
- Strukturen til benzenmolekylet (studentmelding). (lysbilde 4).
- Selvstendig arbeid av studenter (i 5-7 minutter). (lysbilde 5).
- fyll ut feltene i definisjonen av aromatiske hydrokarboner;
- skriv formlene til de gitte stoffene;
- fullføre reduksjonen av reaksjoner som produserer aromatiske hydrokarboner.
III. Lære nytt stoff.
1. Fysiske egenskaper til benzen. (lysbilde 6).
Benzen er en fargeløs, flyktig, brennbar væske med en ubehagelig lukt. Det er lettere enn vann (=0,88 g/cm3) og blander seg ikke med det, men det er løselig i organiske løsemidler, og løser selv mange stoffer godt. Benzen koker ved 80,1 C; når det avkjøles, stivner det lett til en hvit krystallinsk masse. Benzen og dets damper er giftig. Systematisk innånding av dampene forårsaker anemi og leukemi.
– Videomateriale (fysiske egenskaper til benzen).
2. Kjemiske egenskaper til benzen.
1) De kjemiske egenskapene til benzen bestemmes av strukturen til molekylet.
2) Det aromatiske systemet har økt stabilitet.
3) Derfor, selv om benzen er et umettet hydrokarbon, viser det egenskaper som er karakteristiske for mettede hydrokarboner (tilbøyelighet til substitusjonsreaksjoner, motstand mot oksidasjonsmidler).
Substitusjonsreaksjoner.

Addisjonsreaksjoner (lysbilde 9).
Under visse forhold kan benzen også gjennomgå addisjonsreaksjoner. I disse reaksjonene blir det aromatiske systemet ødelagt, så de krever tøffe forhold for å oppstå.

Oksidasjonsreaksjoner. (Lysbilde 10).
a) forholdet mellom benzen og bromvann og kaliumpermanganat (videomateriale)
b) forbrenning av benzen
2C 6 H 6 + 15O 2 –> 2CO 2 + 6H 2 O
IV. Konsolidering.
(lysbilde 11).- Benzen reagerer med hvert stoff i settet:
a) Br 2, O 2, KMnO 4
b) H 2 O, HNO 3, CI 2
c) Cl 2, O 2, HNO 3
d) HCl, Br2, H2
Skriv ligningene for reaksjonene av benzen med stoffene i dette settet, angi betingelsene for deres forekomst.
V. Lekser.
Identifiser stoffene X, Y, Z i transformasjonsordningen:
Litteratur:
- Rudzitis G.E., Feldman F.G. Organisk kjemi: Lærebok for 10 klassetrinn ved allmennutdanningsinstitusjoner. – 8. utg. – M.: Utdanning, 2002.
- Novoshinsky I.I., Novoshinskaya N.S. Organisk kjemi. 11. klasse: Lærebok for allmennutdanningsinstitusjoner. – M.: Forlag “Education”, 2005.
Fru Khimiya skaffet seg endelig og ugjenkallelig en slik forbindelse som benzen først i 1833. Benzen er en forbindelse som har en hettemperert, man kan til og med si eksplosiv, karakter. Hvordan fant de ut av det?
Historie
Johann Glauber i 1649 vendte oppmerksomheten mot en forbindelse som ble dannet med hell da en kjemiker behandlet kulltjære. Men den ønsket å forbli inkognito.
Omtrent 170 år senere, eller for å være mye mer presis, på midten av tjuetallet av 1800-tallet ble det ved en tilfeldighet utvunnet benzen fra den lysende gassen, nemlig fra det frigjorte kondensatet. Menneskeheten skylder en slik innsats til Michael Faraday, en vitenskapsmann fra England.
Stafettpinnen for anskaffelse av benzen ble overtatt av tyskeren Eilgard Mitscherlich. Dette skjedde under behandlingen av vannfrie kalsiumsalter av benzosyre. Kanskje det er derfor forbindelsen ble gitt et slikt navn - benzen. Alternativt kalte forskeren det bensin. Røkelse, hvis oversatt fra arabisk.
Benzen brenner vakkert og sterkt; i forbindelse med disse observasjonene anbefalte Auguste Laurent å kalle det "fen" eller "benzen". Lyse, skinnende - hvis oversatt fra gresk.
Basert på konseptet om naturen til elektronisk kommunikasjon og kvalitetene til benzen, ga forskeren molekylet til forbindelsen i form av følgende bilde. Dette er en sekskant. En sirkel er skrevet inn i den. Ovennevnte antyder at benzen har en komplett elektronsky, som trygt omslutter seks (uten unntak) karbonatomer i syklusen. Ingen festede binære bindinger observeres.
Benzen ble tidligere brukt som løsningsmiddel. Men i utgangspunktet, som de sier, var han ikke medlem, deltok ikke, var ikke involvert. Men dette er på 1800-tallet. Betydelige endringer skjedde på 1900-tallet. Egenskapene til benzen uttrykker de mest verdifulle egenskapene som har hjulpet den til å bli mer populær. Oktantallet, som viste seg å være høyt, gjorde det mulig å bruke det som drivstoffelement for tanking av biler. Denne handlingen fungerte som drivkraften for den omfattende tilbaketrekkingen av benzen, utvinningen utføres som et sekundært produkt fra produksjon av koksstål.
I førtiårene begynte benzen å bli brukt i det kjemiske feltet til fremstilling av stoffer som raskt eksploderer. Det 20. århundre kronet seg med at oljeraffineringsindustrien produserte så mye benzen at den begynte å forsyne den kjemiske industrien.
Kjennetegn på benzen
Umettede hydrokarboner ligner veldig på benzen. For eksempel karakteriserer etylenhydrokarbonserien seg som et umettet hydrokarbon. Det er preget av en addisjonsreaksjon. Benzen går lett inn i alt dette takket være atomene som er i samme plan. Og som et faktum - en konjugert elektronsky.

Hvis en benzenring er til stede i formelen, kan vi komme til den elementære konklusjonen at det er benzen, hvis strukturformel ser akkurat slik ut.
Fysiske egenskaper
Benzen er en væske som ikke har farge, men som har en beklagelig lukt. Benzen smelter når temperaturen når 5,52 grader Celsius. Koker ved 80,1. Tettheten er 0,879 g/cm 3, molmassen er 78,11 g/mol. Ved brenning ryker det mye. Danner eksplosive forbindelser når luft kommer inn. bergarter (bensin, eter og andre) kombineres med det beskrevne stoffet uten problemer. Skaper en azeotropisk forbindelse med vann. Oppvarming før fordamping begynner ved 69,25 grader (91 % benzen). Ved 25 grader Celsius kan det løses opp i vann 1,79 g/l.
Kjemiske egenskaper
Benzen reagerer med svovelsyre og salpetersyre. Og også med alkener, halogener, kloralkaner. Substitusjonsreaksjonen er det som er karakteristisk for den. Trykktemperaturen påvirker benzenringens gjennombrudd, som skjer under ganske tøffe forhold.
Vi kan vurdere hver benzenreaksjonsligning mer detaljert.
1. Elektrofil substitusjon. Brom, i nærvær av en katalysator, reagerer med klor. Som et resultat får vi klorbenzen:
C6H6+3Cl2 → C6H5Cl + HCl
2. Friedel-Crafts-reaksjon, eller alkylering av benzen. Utseendet til alkylbenzener oppstår på grunn av kombinasjonen med alkaner, som er halogenderivater:
C6H6 + C2H5Br → C6H5C2H5 + HBr
3. Elektrofil substitusjon. Her finner reaksjonen av nitrering og sulfonering sted. Ligningen for benzen vil se slik ut:
C6H6 + H2SO4 → C6H5SO3H + H2O
C6H6 + HNO3 → C6H5NO2 + H2O
4. Benzen ved brenning:
2C6H6 + 1502 → 12CO2 + 6H2O
Under visse forhold viser den en karakteristikk av mettede hydrokarboner. P-elektronskyen, som befinner seg i strukturen til det aktuelle stoffet, forklarer disse reaksjonene.
Ulike typer benzen er avhengig av spesiell teknologi. Det er her petroleumsbenzen er merket. For eksempel renset og høyrenset, for syntese. Jeg ønsker å merke separat benzenhomologer, og mer spesifikt deres kjemiske egenskaper. Dette er alkylbenzener.

Benzenhomologer reagerer mye lettere. Men de ovennevnte reaksjonene av benzen, nemlig homologer, finner sted med noen forskjeller.
Halogenering av alkylbenzener
Formen på ligningen er som følger:
C6H5-CH3 + Br = C6H5-CH2Br + HBr.
Tendensen til brom inn i benzenringen er ikke observert. Den kommer ut i kjedet fra siden. Men takket være Al(+3)-saltkatalysatoren kommer brom lett inn i ringen.
Nitrering av alkylbenzener
Takket være svovelsyre og salpetersyre nitreres benzener og alkylbenzener. Reaktive alkylbenzener. To av de presenterte tre produktene oppnås - disse er para- og orto-isomerer. Du kan skrive en av formlene:
C6H5 - CH3 + 3HNO3 -> C6H2CH3 (NO2)3.
Oksidasjon
Dette er uakseptabelt for benzen. Men alkylbenzener reagerer lett. For eksempel benzosyre. Formelen er gitt nedenfor:
C6H5CH3 + [O] → C6H5COOH.
Alkylbenzen og benzen, deres hydrogenering
I nærvær av en forsterker begynner hydrogen å reagere med benzen, noe som resulterer i dannelsen av cykloheksan, som diskutert ovenfor. På samme måte omdannes alkylbenzener lett til alkylcykloheksaner. For å oppnå alkylcykloheksan er det nødvendig å hydrogenere ønsket alkylbenzen. Dette er i utgangspunktet en nødvendig prosedyre for å produsere et rent produkt. Og dette er ikke alle reaksjonene til benzen og alkylbenzen.
Benzen produksjon. Industri
Grunnlaget for slik produksjon er basert på bearbeiding av komponenter: toluen, nafta, tjære, som frigjøres under krakking av kull og andre. Derfor produseres benzen ved petrokjemiske og metallurgiske virksomheter. Det er viktig å vite hvordan man får benzen med varierende renhetsgrad, fordi produksjonsprinsippet og formålet avhenger direkte av merket til dette stoffet.
Brorparten produseres ved termokatalytisk reformering av caustobiolittdelen, kokende ved 65 grader, med ekstrakteffekt, destillasjon med dimetylformamid.
Ved produksjon av etylen og propylen oppnås flytende produkter som dannes under dekomponering av uorganiske og organiske forbindelser under påvirkning av varme. Benzen er isolert fra dem. Men dessverre er det ikke så mye kildemateriale for dette alternativet for benzenekstraksjon. Derfor utvinnes stoffet vi er interessert i ved å reformere. Ved denne metoden økes volumet av benzen.

Ved dealkylering ved en temperatur på 610-830 grader med et plusstegn, i nærvær av damp dannet ved koking av vann og hydrogen, oppnås benzen fra toluen. Det er et annet alternativ - katalytisk. Når tilstedeværelsen av zeolitter, eller alternativt oksidkatalysatorer, observeres, underlagt et temperaturregime på 227-627 grader.
Det finnes en annen, eldre, metode for å utvikle benzen. Ved hjelp av absorpsjon av absorbenter av organisk opprinnelse, isoleres det fra sluttresultatet av kokskull. Produktet er et damp-gass-produkt og er avkjølt på forhånd. For eksempel brukes olje, hvis kilde er petroleum eller kull. Når destillasjon utføres med damp, separeres absorbenten. Hydrobehandling hjelper til med å fjerne overflødige stoffer fra råbenzen.
Kullråvarer
I metallurgi, når du bruker kull, eller, for å være mer presis, tørrdestillering av det, oppnås koks. Under denne prosedyren er lufttilførselen begrenset. Ikke glem at kull varmes opp til en temperatur på 1200-1500 Celsius.
Kullkjemisk benzen trenger grundig rensing. Det er viktig å kvitte seg med metylcykloheksan og vennen n-heptan. bør også inndras. Benzen står overfor en prosess med separasjon og rensing, som vil bli utført mer enn én gang.
Metoden beskrevet ovenfor er den eldste, men over tid mister den sin høye posisjon.
Oljefraksjoner
0,3-1,2% - dette er sammensetningsindikatorene til helten vår i råolje. Magre indikatorer for å investere penger og krefter. Det er best å bruke en industriell prosedyre for å behandle petroleumsfraksjoner. Det vil si katalytisk reformering. I nærvær av en aluminium-platina-rhenium-forsterker øker prosentandelen av aromatiske karbohydrater, og indikatoren som bestemmer drivstoffets evne til ikke å antennes spontant under kompresjonen øker.
Pyrolyseharpikser
Hvis vi utvinner petroleumsproduktet vårt fra ikke-faste råvarer, nemlig ved pyrolyse av propylen og etylen som oppstår under produksjonen, vil denne tilnærmingen være den mest akseptable. For å være presis frigjøres benzen fra pyrokondensatet. Dekomponering av visse proporsjoner krever hydrobehandling. Under rengjøringen fjernes svovel og umettede blandinger. Det første resultatet inneholdt xylen, toluen og benzen. Ved å bruke destillasjon, som er ekstraktiv, separeres BTK-gruppen for å produsere benzen.

Hydrodealkylering av toluen
Hovedpersonene i prosessen, en cocktail av hydrogenstrøm og toluen, mates oppvarmet inn i reaktoren. Toluen passerer gjennom katalysatorsjiktet. Under denne prosessen separeres metylgruppen for å danne benzen. En viss metode for rensing er passende her. Resultatet er et svært rent stoff (for nitrering).
Disproporsjonering av toluen
Som et resultat av avvisningen av metylklassen skjer dannelsen til benzen, og xylen oksideres. Transalkylering er observert i denne prosessen. Den katalytiske effekten oppstår takket være palladium, platina og neodym, som er plassert på aluminiumoksid.
Taluen og hydrogen tilføres reaktoren med et stabilt katalysatorsjikt. Dens formål er å forhindre at hydrokarboner setter seg på katalysatorplanet. Strømmen som forlater reaktoren avkjøles, og hydrogen utvinnes trygt for resirkulering. Det som er igjen destilleres tre ganger. I det innledende stadiet fjernes forbindelser som er ikke-aromatiske. Benzen ekstraheres som andre, og det siste trinnet er separasjon av xylener.
Acetylen trimerisering
Takket være arbeidet til den franske fysikalske kjemikeren Marcelin Berthelot begynte benzen å bli produsert fra acetylen. Men det som skilte seg ut var en tung cocktail av mange andre elementer. Spørsmålet var hvordan man skulle senke reaksjonstemperaturen. Svaret ble mottatt først på slutten av førtitallet av 1900-tallet. V. Reppe fant den passende katalysatoren, det viste seg å være nikkel. Trimerisering er det eneste alternativet for å få benzen fra acetylen.

Benzen dannes ved hjelp av aktivt kull. Ved høye varmenivåer passerer acetylen over kullet. Benzen frigjøres hvis temperaturen er minst 410 grader. Samtidig blir det også født ulike aromatiske hydrokarboner. Derfor trenger du godt utstyr som effektivt kan rense acetylen. Med en så arbeidskrevende metode som trimerisering forbrukes mye acetylen. For å få 15 ml benzen, ta 20 liter acetylen. Du kan se hvordan det ser ut og reaksjonen vil ikke ta lang tid.
3C2H2 → C6H6 (Zelinsky-ligning).
3CH -> CH = (t, kat) = C6H6.
Hvor brukes benzen?
Benzen er et ganske populært hjernebarn innen kjemi. Det ble spesielt ofte lagt merke til hvordan benzen ble brukt i produksjonen av kumen, cykloheksan og etylbenzen. For å lage styren kan du ikke klare deg uten etylbenzen. Utgangsmaterialet for produksjon av kaprolaktam er cykloheksan. Ved fremstilling av termoplastisk harpiks brukes kaprolaktam. Det beskrevne stoffet er uunnværlig ved fremstilling av forskjellige malinger og lakker.
Hvor farlig er benzen?
Benzen er et giftig stoff. Manifestasjonen av en følelse av ubehag, som er ledsaget av kvalme og alvorlig svimmelhet, er et tegn på forgiftning. Selv døden kan ikke utelukkes. En følelse av ubeskrivelig glede er ikke mindre alarmerende bjeller for benzenforgiftning.
Benzen i flytende form forårsaker hudirritasjon. Benzendamper trenger lett gjennom selv intakt hud. Med svært kortvarige kontakter med stoffet i en liten dose, men med jevne mellomrom, vil ikke ubehagelige konsekvenser vente på seg. Dette kan være benmargsskade og akutt leukemi av ulike typer.

I tillegg forårsaker stoffet avhengighet hos mennesker. Benzen fungerer som dop. Tobakksrøyk produserer et tjærelignende produkt. Da de studerte det, kom de til den konklusjon at innholdet er utrygt for mennesker. I tillegg til tilstedeværelsen av nikotin, ble det også oppdaget tilstedeværelsen av aromatiske karbohydrater som benzpyren. Et særtrekk ved benzopyren er at det er kreftfremkallende. De har en veldig skadelig effekt. For eksempel forårsaker de kreft.
Til tross for ovennevnte er benzen et utgangsråmateriale for produksjon av en rekke medisiner, plast, syntetisk gummi og selvfølgelig fargestoffer. Dette er det vanligste hjernebarnet innen kjemi og en aromatisk forbindelse.
Den sykliske strukturen til benzen ble først foreslått av F.A. Kekule i 1865

Friedrich August Kekule von Stradonitz - en fremragende tysk kjemiker på 1800-tallet. I 1854 oppdaget han den første organiske forbindelsen som inneholdt svovel - tioeddiksyre (tioetansyre). I tillegg etablerte han strukturen til diazoforbindelser. Imidlertid er hans mest kjente bidrag til utviklingen av kjemi etableringen av strukturen til benzen (1866). Kekule viste at dobbeltbindingene til benzen vekslet rundt ringen (denne ideen kom først opp for ham i en drøm). Han viste senere at de to mulige dobbeltbindingsarrangementene er identiske og at benzenringen er en hybrid mellom disse to strukturene. Dermed forutså han ideen om resonans (mesomerisme), som dukket opp i teorien om kjemisk binding på begynnelsen av 1930-tallet.
Hvis benzen virkelig hadde en slik struktur, burde dets 1,2-disubstituerte derivater ha to isomerer. For eksempel,

Imidlertid kan ingen av de 1,2-disubstituerte benzenene isoleres i to isomerer.
Derfor foreslo Kekule senere at benzenmolekylet eksisterer som to strukturer som raskt forvandler seg til hverandre:

Merk at slike skjematiske representasjoner av benzenmolekyler og deres derivater vanligvis ikke indikerer hydrogenatomene festet til karbonatomene i benzenringen.
I moderne kjemi regnes benzenmolekylet som en resonanshybrid av disse to begrensende resonansformene (se avsnitt 2.1). En annen beskrivelse av benzenmolekylet er basert på en vurdering av dets molekylære orbitaler. I Sect. 3.1 ble det indikert at -elektroner lokalisert i -bindende orbitaler er delokalisert mellom alle karbonatomer i benzenringen og danner en -elektronsky. I samsvar med denne representasjonen kan benzenmolekylet konvensjonelt avbildes som følger:
Eksperimentelle data bekrefter tilstedeværelsen av nettopp en slik struktur i benzen. Hvis benzen hadde strukturen som Kekulé opprinnelig foreslo, med tre konjugerte dobbeltbindinger, skulle benzen gjennomgå addisjonsreaksjoner som alkener. Imidlertid, som nevnt ovenfor, gjennomgår ikke benzen addisjonsreaksjoner. I tillegg er benzen mer stabilt enn om det hadde tre isolerte dobbeltbindinger. I Sect. 5.3 ble det indikert at entalpien til benzenhydrogenering for å danne cykloheksan har en større negativ
Tabell 18.3. Lengden på ulike karbon-karbonbindinger


Ris. 18.6. Geometrisk struktur av benzenmolekylet.
verdi enn tredoblet entalpien for hydrogenering av cykloheksen. Forskjellen mellom disse mengdene kalles vanligvis entalpien for delokalisering, resonansenergi eller stabiliseringsenergi av benzen.
Alle karbon-karbonbindinger i benzenringen har samme lengde, som er kortere enn lengden på C-C-bindingene i alkaner, men lengre enn lengden på C=C-bindingene i alkener (tabell 18.3). Dette bekrefter at karbon-karbonbindingene i benzen er en hybrid mellom enkelt- og dobbeltbindinger.
Benzenmolekylet har en flat struktur, som er vist i fig. 18.6.
Fysiske egenskaper
Benzen under normale forhold er en fargeløs væske som fryser ved 5,5 °C og koker ved 80 °C. Den har en karakteristisk behagelig lukt, men er, som nevnt ovenfor, svært giftig. Benzen blandes ikke med vann og i et benzensystem danner vann det øverste av de to lagene. Imidlertid er det løselig i ikke-polare organiske løsningsmidler og er i seg selv et godt løsningsmiddel for andre organiske forbindelser.
Kjemiske egenskaper
Selv om benzen gjennomgår visse addisjonsreaksjoner (se nedenfor), viser det ikke den reaktiviteten som er typisk for alkener. For eksempel misfarger den ikke bromvann eller -ionløsning. Dessuten er ikke benzen det
inngår addisjonsreaksjoner med sterke syrer, som salt- eller svovelsyre.
Samtidig deltar benzen i en rekke elektrofile substitusjonsreaksjoner. Produktene av denne typen reaksjon er aromatiske forbindelser, siden i disse reaksjonene beholdes det delokaliserte elektroniske systemet av benzen. Den generelle mekanismen for å erstatte et hydrogenatom på benzenringen med en elektrofil er beskrevet i avsnitt. 17.3. Eksempler på elektrofil substitusjon av benzen er nitrering, halogenering, sulfonering og Friedel-Crafts-reaksjoner.
Nitrering. Benzen kan nitreres (en gruppe tilsatt til det) ved å behandle det med en blanding av konsentrerte salpetersyre og svovelsyre:

Nitrobenzen
Betingelsene for denne reaksjonen og dens mekanisme er beskrevet i avsnitt. 17.3.
Nitrobenzen er en blekgul væske med en karakteristisk mandellukt. Når benzen nitreres, dannes det i tillegg til nitrobenzen også krystaller av 1,3-dinitrobenzen, som er produktet av følgende reaksjon:

Halogenering. Hvis du blander benzen med klor eller brom i mørket, vil det ikke oppstå noen reaksjon. Imidlertid, i nærvær av katalysatorer som har egenskapene til Lewis-syrer, forekommer elektrofile substitusjonsreaksjoner i slike blandinger. Typiske katalysatorer for disse reaksjonene er jern(III)bromid og aluminiumklorid. Virkningen til disse katalysatorene er at de skaper polarisering i halogenmolekylene, som deretter danner et kompleks med katalysatoren:
selv om det ikke er noen direkte bevis for at det dannes frie ioner i dette tilfellet. Mekanismen for benzenbromering ved bruk av jern (III) bromid som en ionebærer kan representeres som følger:

Sulfonering. Benzen kan sulfoneres (erstatt et hydrogenatom med en sulfogruppe) ved å koke blandingen med tilbakeløp med konsentrert svovelsyre i flere timer. I stedet kan benzen forsiktig varmes opp i en blanding med rykende svovelsyre. Rykende svovelsyre inneholder svoveltrioksid. Mekanismen for denne reaksjonen kan representeres av diagrammet

Friedel-Crafts reaksjoner. Friedel-Crafts-reaksjoner ble opprinnelig kalt kondensasjonsreaksjoner mellom aromatiske forbindelser og alkylhalogenider i nærvær av en vannfri aluminiumkloridkatalysator.
I kondensasjonsreaksjoner kombineres to molekyler av reagenser (eller ett reagens) med hverandre, og danner et molekyl av en ny forbindelse, mens et molekyl av en enkel forbindelse, som vann eller hydrogenklorid, spaltes (eliminerer) fra dem.
For tiden kalles Friedel-Crafts-reaksjonen enhver elektrofil substitusjon av en aromatisk forbindelse der rollen som en elektrofil spilles av et karbokation eller et sterkt polarisert kompleks med et positivt ladet karbonatom. Det elektrofile middelet er som regel et alkylhalogenid eller klorid av en eller annen karboksylsyre, selv om det også kan være for eksempel en alken eller en alkohol. Vannfritt aluminiumklorid brukes vanligvis som katalysator for disse reaksjonene. Friedel-Crafts-reaksjoner er vanligvis delt inn i to typer: alkylering og acylering.
Alkylering. I denne typen Friedel-Crafts-reaksjon er ett eller flere hydrogenatomer på benzenringen erstattet med alkylgrupper. For eksempel, når en blanding av benzen og klormetan oppvarmes forsiktig i nærvær av vannfritt aluminiumklorid, dannes metylbenzen. Klorometan spiller rollen som et elektrofilt middel i denne reaksjonen. Det er polarisert av aluminiumklorid på samme måte som halogenmolekyler:
Mekanismen for reaksjonen under vurdering kan presenteres som følger:

Det skal bemerkes at i denne kondensasjonsreaksjonen mellom benzen og klormetan, elimineres et hydrogenkloridmolekyl. Merk også at den virkelige eksistensen av metallkarbokasjonen i form av et fritt ion er tvilsom.
Alkylering av benzen med klormetan i nærvær av en katalysator - vannfritt aluminiumklorid resulterer ikke i dannelse av metylbenzen. I denne reaksjonen skjer ytterligere alkylering av benzenringen, noe som fører til dannelse av 1,2-dimetylbenzen:

Acylering. I denne typen Friedel-Crafts-reaksjon erstattes et hydrogenatom på benzenringen med en acylgruppe, noe som resulterer i dannelsen av et aromatisk keton.
Acylgruppen har den generelle formelen
Det systematiske navnet på en acylforbindelse dannes ved å erstatte suffikset og endelsen -ova i navnet til den tilsvarende karboksylsyren, som denne acylforbindelsen er et derivat av, med suffikset -(o)yl. For eksempel

Acyleringen av benzen utføres ved å bruke kloridet eller anhydridet av en hvilken som helst karboksylsyre i nærvær av en katalysator, vannfritt aluminiumklorid. For eksempel

Denne reaksjonen er en kondensasjon der et hydrogenkloridmolekyl elimineres. Merk også at navnet "fenyl" ofte brukes for å referere til benzenringen i forbindelser der benzen ikke er hovedgruppen:

Tilleggsreaksjoner. Selv om benzen er mest preget av elektrofile substitusjonsreaksjoner, gjennomgår det også noen addisjonsreaksjoner. Vi har allerede møtt en av dem. Vi snakker om hydrogenering av benzen (se avsnitt 5.3). Når en blanding av benzen og hydrogen føres over overflaten av en finmalt nikkelkatalysator ved en temperatur på 150-160 °C, oppstår en hel sekvens av reaksjoner som ender med dannelsen av cykloheksan. Den samlede støkiometriske ligningen for denne reaksjonen kan representeres som følger:

Når det utsettes for ultrafiolett stråling eller direkte sollys, reagerer benzen også med klor. Denne reaksjonen skjer via en kompleks radikal mekanisme. Sluttproduktet er 1,2,3,4,5,6-heksaklorcykloheksan:

En lignende reaksjon oppstår mellom benzen og brom under påvirkning av ultrafiolett stråling eller sollys.
Oksidasjon. Benzen og benzenringen i andre aromatiske forbindelser er generelt sett motstandsdyktige mot oksidasjon selv med så sterke oksidasjonsmidler som en sur eller alkalisk løsning av kaliumpermanganat. Imidlertid brenner benzen og andre aromatiske forbindelser i luft eller oksygen for å produsere en svært røykfylt flamme, som er typisk for hydrokarboner med et høyt relativt karboninnhold.

Benzenhomologer er i stand til å reagere i to retninger med deltakelse av en aromatisk kjerne og en sidekjede (alkylgrupper), avhengig av reagensens natur.
1.Reaksjoner på den aromatiske ringen
På grunn av donoreffekten til alkylgruppen fortsetter S E ArH-reaksjonene inn orto- Og par-posisjon av den aromatiske ringen, mens forholdene er mildere enn for benzen.
a) halogenering

b) nitrering


Legg merke til hvordan, når antallet akseptorgrupper (-NO2) øker, øker temperaturen på nitreringsreaksjonene.
c) sulfonering

Reaksjonen produserer hovedsakelig P-isomer.
d) alkylering

e) acylering

2. Sidekjedereaksjoner
Alkylfragmentet til benzenmolekylet går inn i S R-reaksjoner som involverer karbonatomet i α -posisjon (benzylposisjon).


Oksidasjon av alle benzenhomologer med KMnO 4 /100°C fører til dannelse av benzosyre.
Kondenserte arenaer

Kondenserte arener er aromatiske systemer (n=2 og 3). Graden av aromatisitet til kondenserte arener er lavere enn for benzen. De er preget av elektrofile substitusjonsreaksjoner, addisjons- og oksidasjonsreaksjoner, som skjer under mildere forhold enn for benzen.
Reaktivitet av naftalen
S E ArH-reaksjonene for naftalen foregår hovedsakelig iht α -posisjon, med unntak av sulfonering. Den elektrofile tilsetningen av Ad E skjer ved posisjonene 1,4, med naftalen som viser egenskapene til konjugerte diener.
1. Elektrofile substitusjonsreaksjoner,S E ArH


2.Reaksjoner av elektrofil addisjon, reduksjon og oksidasjon.


Reaktivitet av antracen og fenantren
Reaksjonene med elektrofil substitusjon, S E ArH og elektrofil addisjon, Ad E for antracen forekommer hovedsakelig ved posisjon 9 og 10 (se diagrammet nedenfor).

Reaksjonene med elektrofil substitusjon, S E ArH og elektrofil addisjon, Ad E for fenantren forekommer hovedsakelig ved posisjon 9 og 10, som for antracen (se diagrammet nedenfor).

Oksidasjons- og reduksjonsreaksjoner for antracen og fenantren.


Strukturer av noen legemidler basert på naftalen, antracen og fenantren
Naftyzin(nafazolin, sanorin)

vasokonstriktor effekt(behandling av rhinitt, bihulebetennelse)
(den originale strukturen er fremhevet i tittelen, vær oppmerksom på nummereringen)
Naftifin

soppdrepende handling (behandling av dermatitt)
Nabumethon

antiinflammatorisk, febernedsettende, smertestillende effekt(behandling av slitasjegikt, revmatoid artritt).
Nadolol

(begrepet cis, i dette tilfellet, betegner den relative posisjonen til hydroksylgrupper)
hypotensive(senker blodtrykket) og antiarytmisk effekt
Morfin, kodein

Testspørsmål for kapittelet «ARENAER»
1. Hvilke egenskaper ved benzen skiller det fra andre umettede forbindelser - alkener, alkyner? Hva betyr begrepet "aromatisk sammensetning"?
2. Skriv strukturformlene til forbindelsene: a) etylbenzen; b) 1,3-dimetylbenzen ( m -xylen); c) 1,3,5-trimetylbenzen (mesitylen); d) isopropylbenzen (kumen); e) 3-fenylpentan; f) vinylbenzen (styren); g) fenylacetylen; h) transe -difenyletylen ( transe -stilben).
3. Beskriv de strukturelle egenskapene til forbindelser som viser aromatisitet. Formuler Hückels regel. Hvilke av følgende forbindelser er aromatiske:

4. Sammenlign forholdet mellom cykloheksen og benzen med følgende reagenser under de angitte forholdene : a) Br 2 (H 2 Å, 20 C); b) KMnO 4 (H 2 O.0 C); c) N 2 SÅ 4 (kons.), 20 C; d) H 2 (Pd, 30 C); før 3 , deretter H 2 O(Zn); f) HBr.
5. Skriv strukturformlene for monosubstituerte benzener dannet i reaksjonene av benzen med følgende reagenser: a) N 2 SÅ 4 (kons.); b) HNO 3 ; N 2 SÅ 4 (kons.); c) Br 2 /Fe; d) Cl 2 /AlCl 3 ; e) CH 3 Br/AlBr 3 ; e) CH 3 COCl/AlCl 3 . Nevn reaksjonene og produktene deres. Angi hvilken elektrofil benzen som reagerer i hvert enkelt tilfelle.
6. Gi et generelt skjema for interaksjonen av benzen med et elektrofilt reagens ( E + ). Nevn de mellomliggende kompleksene. Hvilket trinn bestemmer vanligvis hastigheten på en reaksjon? Gi en graf over endringen i potensiell energi til reaksjonen under vurdering.
7. Definer følgende begreper: a) overgangstilstand; b) mellomforbindelse; c) -kompleks; d)-kompleks. Hvilke av dem er identiske? Illustrer disse konseptene ved å bruke eksemplet med benzenbromering i nærvær av en katalysator. FeBr 3 .
8. Ved å bruke eksempelet på reaksjonene av eten og benzen med brom, sammenligne mekanismen for elektrofil addisjon i alkener med mekanismen for elektrofil substitusjon i den aromatiske serien. På hvilket stadium observeres forskjellen og hvorfor?
9. Bruk induktive og mesomere effekter, beskriv interaksjonen mellom substituenten og benzenringen i de angitte forbindelsene:

Merk de elektrondonerende (ED) og elektrontiltrekkende (EA) substituentene.
10. Skriv skjemaer for mononitrering av forbindelser: a) fenol; b) benzensulfonsyrer; c) isopropylbenzen; d) klorbenzen. For hvilken forbindelse skal den relative substitusjonsraten være høyest og hvorfor?
11. Dannelsen av hvilke produkter som bør forventes under monosulfonering av forbindelser: a) toluen; b) nitrobenzen; c) benzosyre; d) brombenzen? Hvilken forbindelse bør sulfonere lettest? Hvorfor?
12. Ordne følgende forbindelser i rekkefølge for å øke reaktiviteten når de bromeres til en benzenring: a) benzen; b) fenol; c) benzaldehyd; d) etylbenzen. Gi en forklaring.
13. Nevn følgende hydrokarboner:

14. Skriv reaksjonene til benzen med følgende reagenser : a) Cl 2 (Fe); b) 3Cl 2 (lys); c) HNO 3 (H 2 SÅ 4 ); d) O 2 (luft) (V 2 OM 5 , 450 C); e) 3O 3 , deretter N 2 O (Zn); e) H 2 SÅ 4 (oleum); g) 3H 2 (Ni, 200 C,s ). Hva er trekk ved addisjonsreaksjoner i benzen?
15. Skriv reaksjonene til toluen med de angitte reagensene : a) 3H 2 (Ni, 200 C, 9806,7 kPa); b) KMnO 4 V N 2 OM; c*) Cl 2 , lys; d*) Cl 2 (Fe); d*) CH 3 Cl(AlCl 3 ); e*) CH 3 COCl (AlCl 3 ); g) HNO 3 (H 2 SÅ 4 ). For reaksjoner merket med en stjerne, gi mekanismer.
16. Skriv reaksjonene ved nitrering av etylbenzen under de angitte forholdene: a) 65 % HNO 3 +H 2 SÅ 4 (kons.); b) 10 % HNO 3 , oppvarming, trykk. Ta med mekanismene.
17. Sammenlign forholdet mellom isopropylbenzen og brom: a) i nærvær AlBr 3 ; b) under belysning og oppvarming. Gi reaksjonene og deres mekanismer.
18. Hvilke forbindelser dannes av etylbenzen og P -xylen under påvirkning av de angitte oksidasjonsmidlene: a) O 3 , deretter H 2 O(Zn); b) KMnO 4 i H 2 OM,t ; VC 2 Cr 2 O 7 i H 2 SÅ 4 , t ?
19. Ved hjelp av hvilke reaksjoner kan følgende par av forbindelser skilles ut: a) etylbenzen og m -xylen; b) etylbenzen og styren; c) styren og fenylacetylen; G) O - Og P -xylener?
20. Hvilke forbindelser er produktene av reaksjonene nedenfor:

21. Basert på benzen og eventuelle andre reagenser, få forbindelsene nedenfor: a) P -gnir -butyltoluen; b) etyl- P -tolylketon; c) alylbenzen; G) P -brombenzosyre.
22. Nevn hovedforbindelsene som dannes i følgende reaksjoner:

Den første gruppen av reaksjoner er substitusjonsreaksjoner. Vi sa at arener ikke har flere bindinger i strukturen til molekylet, men inneholder et konjugert system av seks elektroner, som er veldig stabilt og gir ekstra styrke til benzenringen. Derfor, i kjemiske reaksjoner, skjer erstatning av hydrogenatomer først, og ikke ødeleggelsen av benzenringen.
Vi har allerede møtt substitusjonsreaksjoner når vi snakker om alkaner, men for dem fulgte disse reaksjonene en radikal mekanisme, mens arener er preget av en ionisk mekanisme for substitusjonsreaksjoner.
Først halogenering av kjemiske egenskaper. Erstatning av et hydrogenatom med et halogenatom, klor eller brom.
Reaksjonen skjer ved oppvarming og alltid med deltagelse av en katalysator. Når det gjelder klor, kan det være aluminiumklorid eller jernklorid tre. Katalysatoren polariserer halogenmolekylet, forårsaker heterolytisk bindingsspaltning og produserer ioner.
Klor er et positivt ladet ion og reagerer med benzen.
Hvis reaksjonen skjer med brom, er katalysatoren jernbromid eller aluminiumbromid.

Det er viktig å merke seg at reaksjonen skjer med molekylært brom og ikke med bromvann. Benzen reagerer ikke med bromvann.
Halogeneringen av benzenhomologer har sine egne egenskaper. I toluenmolekylet letter metylgruppen substitusjon i ringen, reaktiviteten øker, og reaksjonen skjer under mildere forhold, det vil si ved romtemperatur.

Det er viktig å merke seg at substitusjon alltid skjer i orto- og para-posisjonene, så en blanding av isomerer oppnås.
Sekund egenskap nitrering av benzen, innføring av en nitrogruppe i benzenringen.

En tung gulaktig væske med lukten av bitre mandler dannes nitrobenzen, så reaksjonen kan være kvalitativ til benzen. For nitrering brukes en nitreringsblanding av konsentrert salpetersyre og svovelsyre. Reaksjonen utføres ved oppvarming.
La meg minne deg på at for nitrering av alkaner i Konovalov-reaksjonen ble fortynnet salpetersyre brukt uten tilsetning av svovelsyre.
Under nitrering av toluen, så vel som under halogenering, dannes en blanding av orto- og para-isomerer.

Tredje egenskapsalkylering av benzen med haloalkaner.

Denne reaksjonen tillater innføring av et hydrokarbonradikal i benzenringen og kan betraktes som en metode for fremstilling av benzenhomologer. Aluminiumklorid brukes som en katalysator, som fremmer nedbrytningen av haloalkanmolekylet til ioner. Oppvarming er også nødvendig.
Fjerde egenskapsalkylering av benzen med alkener.

På denne måten kan du få tak i for eksempel kumen eller etylbenzen. Katalysator aluminiumklorid.
2. Tilsetningsreaksjoner til benzen
Den andre gruppen av reaksjoner er addisjonsreaksjoner. Vi sa at disse reaksjonene ikke er typiske, men de er mulige under ganske strenge forhold med ødeleggelsen av pi-elektronskyen og dannelsen av seks sigma-bindinger.
Femte egenskap i den generelle listen hydrogenering, tilsetning av hydrogen.
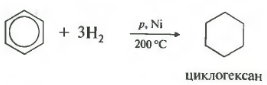
Temperatur, trykk, katalysator nikkel eller platina. Toluen kan reagere på samme måte.
Sjette eiendomsklorering. Vær oppmerksom på at vi snakker spesifikt om interaksjon med klor, siden brom ikke kommer inn i denne reaksjonen.

Reaksjonen skjer under sterk ultrafiolett bestråling. Heksaklorcykloheksan, et annet navn for heksakloran, et fast stoff, dannes.
Det er viktig å huske det for benzen ikke mulig addisjonsreaksjoner av hydrogenhalogenider (hydrohalogenering) og tilsetning av vann (hydrering).
3. Substitusjon i sidekjeden til benzenhomologer
Den tredje gruppen av reaksjoner gjelder bare benzenhomologer - dette er en substitusjon i sidekjeden.
Syvende egenskap i den generelle listen halogenering ved alfa-karbonatomet i sidekjeden.

Reaksjonen skjer ved oppvarming eller bestråling og alltid kun ved alfakarbon. Når halogeneringen fortsetter, vil det andre halogenatomet gå tilbake til alfa-posisjonen.
4. Oksidasjon av benzenhomologer
Den fjerde gruppen av reaksjoner er oksidasjon.
Benzenringen er for sterk, så benzen oksiderer ikke kaliumpermanganat misfarger ikke løsningen. Dette er veldig viktig å huske.
Men benzenhomologer oksideres av en surgjort løsning av kaliumpermanganat når de varmes opp. Og dette er den åttende kjemiske egenskapen.

Dette produserer benzosyre. Misfarging av løsningen observeres. I dette tilfellet, uansett hvor lang karbonkjeden til substituenten er, brytes den alltid etter det første karbonatomet og alfaatomet oksideres til en karboksylgruppe med dannelse av benzosyre. Resten av molekylet oksideres til den tilsvarende syren eller, hvis det bare er ett karbonatom, til karbondioksid.
Hvis en benzenhomolog har mer enn en hydrokarbonsubstituent på den aromatiske ringen, skjer oksidasjon i henhold til de samme reglene - karbonet som ligger i alfaposisjonen oksideres.

Dette eksemplet produserer en dibasisk aromatisk syre kalt ftalsyre.
Jeg vil spesielt merke meg oksidasjonen av kumen, isopropylbenzen, av atmosfærisk oksygen i nærvær av svovelsyre.

Dette er den såkalte kumenmetoden for å produsere fenol. Som regel møter man denne reaksjonen i saker knyttet til produksjon av fenol. Dette er en industriell metode.
Niende egenskapsforbrenning, fullstendig oksidasjon med oksygen. Benzen og dets homologer brenner til karbondioksid og vann.
La oss skrive forbrenningsligningen for benzen i generell form.
I følge loven om bevaring av masse skal det være like mange atomer til venstre som det er atomer til høyre. For i kjemiske reaksjoner forsvinner ikke atomer, men rekkefølgen på bindinger mellom dem endres ganske enkelt. Så det vil være like mange karbondioksidmolekyler som det er karbonatomer i arenemolekylet, siden molekylet inneholder ett karbonatom. Det vil si n CO 2 molekyler. Det vil være to ganger færre vannmolekyler enn hydrogenatomer, det vil si (2n-6)/2, som betyr n-3.
Det er like mange oksygenatomer på venstre og høyre side. Til høyre er det 2n fra karbondioksid, fordi hvert molekyl har to oksygenatomer, pluss n-3 fra vann, for totalt 3n-3. Til venstre er det samme antall oksygenatomer 3n-3, som betyr at det er to ganger færre molekyler, fordi molekylet inneholder to atomer. Det vil si (3n-3)/2 oksygenmolekyler.
Dermed har vi satt sammen en ligning for forbrenning av benzenhomologer i generell form.