Svrha i ciljevi lekcije:
– sistematizovati znanja učenika o strukturi molekula benzena i metodama za njegovu pripremu;
– formiraju razumijevanje fizičkih i hemijskih svojstava benzola, nauče kako se sastavljaju jednačine za hemijske reakcije karakteristične za benzol;
– nastaviti razvijati vještine učenika u radu sa video materijalima i multimedijalnim prezentacijama.
Oblici rada: frontalni, individualni.
Oprema: kompjuter, multimedijalni projektor, „Benzol“ stolovi
Napredak lekcije
I. Organizacioni momenat.
Učitelj: Tema, ciljevi i zadaci časa.
II. Aktiviranje znanja učenika.
- Frontalna anketa
- Aromatični ugljovodonici – ARENES
- Definirajte aromatične ugljovodonike.
- Zašto se nazivaju aromatičnim?
- Tipičan predstavnik aromatičnih ugljovodonika je...?
- Čija su imena povezana s porijeklom benzena?
- Koja je molekulska formula benzena?
- Koliko strukturnih formula ima benzen?
- Vrsta hibridizacije?
- Koje veze postoje u molekulu benzena i koliko?
- Koji su najvažniji izvori aromatičnih ugljovodonika?
- Drugi načini dobijanja?
- Imenujte benzen hamloge.
- Struktura molekula benzena (učenička poruka). (Slajd 4).
- Samostalni rad studenata (5-7 minuta). (Slajd 5).
- popuniti prazna polja u definiciji aromatičnih ugljovodonika;
- napisati formule datih supstanci;
- dovršiti redukciju reakcija koje proizvode aromatične ugljovodonike.
III. Učenje novog gradiva.
1. Fizička svojstva benzena. (Slajd 6).
Benzen je bezbojna, isparljiva, zapaljiva tečnost neprijatnog mirisa. Lakši je od vode (=0,88 g/cm3) i ne meša se sa njom, ali je rastvorljiv u organskim rastvaračima, i sam dobro rastvara mnoge supstance. Benzen ključa na 80,1 C kada se ohladi, lako se stvrdne u bijelu kristalnu masu. Benzen i njegove pare su otrovni. Sistematsko udisanje njegovih para uzrokuje anemiju i leukemiju.
– Video materijal (fizička svojstva benzena).
2. Hemijska svojstva benzena.
1) Hemijska svojstva benzena su određena strukturom njegove molekule.
2) Aromatični sistem ima povećanu stabilnost.
3) Dakle, iako je benzen nezasićeni ugljovodonik, on pokazuje svojstva karakteristična za zasićene ugljovodonike (sklonost reakcijama supstitucije, otpornost na oksidacione agense).
Reakcije supstitucije.

Reakcije sabiranja (Slajd 9).
Pod određenim uvjetima, benzen također može biti podvrgnut reakcijama adicije. U ovim reakcijama dolazi do uništenja aromatičnog sistema, pa su za njihovo odvijanje potrebni teški uslovi.

Reakcije oksidacije. (Slajd 10).
a) omjer benzena i bromne vode i kalijum permanganata (video materijal)
b) sagorevanje benzena
2C 6 H 6 + 15O 2 –> 2CO 2 + 6H 2 O
IV. Konsolidacija.
(Slajd 11).- Benzen reaguje sa svakom supstancom u setu:
a) Br 2, O 2, KMnO 4
b) H 2 O, HNO 3, CI 2
c) CI 2, O 2, HNO 3
d) HCI, Br 2, H 2
Napišite jednadžbe za reakcije benzena sa supstancama iz ovog skupa, navedite uslove za njihovu pojavu.
V. Domaći.
Identifikujte supstance X, Y, Z u šemi transformacije:
književnost:
- Rudžitis G.E., Feldman F.G. Organska hemija: Udžbenik za 10. razred opšteobrazovnih ustanova. – 8. izd. – M.: Obrazovanje, 2002.
- Novoshinsky I.I., Novoshinskaya N.S. Organska hemija. 11. razred: Udžbenik za opšteobrazovne ustanove. – M.: Izdavačka kuća „Obrazovanje“, 2005.
Gospođa Khimiya je konačno i neopozivo stekla takvo jedinjenje kao što je benzol tek 1833. godine. Benzen je jedinjenje koje ima zagrejani, čak bi se moglo reći i eksplozivan karakter. Kako ste saznali?
Priča
Johann Glauber je 1649. skrenuo pažnju na spoj koji je uspješno nastao kada je hemičar prerađivao katran ugljena. Ali željelo je ostati inkognito.
Otprilike 170 godina kasnije, tačnije, sredinom dvadesetih godina 19. vijeka, igrom slučaja, benzen je izvučen iz svjetlosnog plina, odnosno iz ispuštenog kondenzata. Čovječanstvo duguje takve napore Michaelu Faradayu, naučniku iz Engleske.
Palicu za nabavku benzena preuzeo je Nijemac Eilgard Mitscherlich. To se dogodilo tokom obrade bezvodnih kalcijumovih soli benzojeve kiseline. Možda je zato jedinjenje dobilo takvo ime - benzen. Alternativno, naučnik ga je nazvao benzinom. Tamjan, ako se prevede sa arapskog.
Benzen gori lijepo i sjajno u vezi sa ovim zapažanjima, Auguste Laurent je preporučio da ga nazovemo "fen" ili "benzen". Svijetlo, sjajno - ako se prevede s grčkog.
Na osnovu koncepta prirode elektronske komunikacije i kvaliteta benzena, naučnik je dao molekul jedinjenja u obliku sledeće slike. Ovo je šestougao. U njega je upisan krug. Gore navedeno sugerira da benzen ima potpuni elektronski oblak, koji sigurno zatvara šest (bez izuzetka) ugljikovih atoma ciklusa. Nisu uočene nikakve pričvršćene binarne veze.
Benzen se ranije koristio kao rastvarač. Ali u suštini, kako kažu, nije bio član, nije učestvovao, nije bio uključen. Ali ovo je u 19. veku. U 20. veku dogodile su se značajne promene. Svojstva benzena izražavaju najvrednije kvalitete koji su mu pomogli da postane popularniji. Oktanski broj, koji se pokazao visokim, omogućio je da se koristi kao gorivni element za punjenje automobila. Ova akcija je bila poticaj za ekstenzivno povlačenje benzena, njegova ekstrakcija se provodi kao sekundarni proizvod proizvodnje čelika za koksovanje.
Do četrdesetih godina benzen je počeo da se koristi u hemijskom polju u proizvodnji supstanci koje brzo eksplodiraju. 20. stoljeće okrunilo se činjenicom da je industrija prerade nafte proizvela toliko benzena da je počela snabdjevati kemijsku industriju.
Karakteristike benzena
Nezasićeni ugljovodonici su vrlo slični benzenu. Na primjer, serija ugljikovodika etilena karakterizira se kao nezasićeni ugljovodonik. Karakterizira ga reakcija adicije. Benzen lako ulazi u sve to zahvaljujući atomima koji se nalaze u istoj ravni. I kao činjenica - konjugovani elektronski oblak.

Ako je u formuli prisutan benzenski prsten, onda možemo doći do elementarnog zaključka da se radi o benzenu, čija strukturna formula izgleda upravo ovako.
Fizička svojstva
Benzen je tečnost koja nema boju, ali ima žalosni miris. Benzen se topi kada temperatura dostigne 5,52 stepena Celzijusa. Vri na 80,1. Gustina je 0,879 g/cm 3, molarna masa 78,11 g/mol. Prilikom gorenja puno dimi. Stvara eksplozivna jedinjenja kada uđe vazduh. kamenje (benzin, etar i drugo) se bez problema spaja sa opisanom supstancom. S vodom stvara azeotropno jedinjenje. Zagrijavanje prije isparavanja počinje na 69,25 stepeni (91% benzena). Na 25 stepeni Celzijusa može se rastvoriti u vodi 1,79 g/l.
Hemijska svojstva
Benzen reaguje sa sumpornom i azotnom kiselinom. Takođe sa alkenima, halogenima, hloroalkanima. Za nju je karakteristična reakcija supstitucije. Temperatura pritiska utiče na probijanje benzenskog prstena, što se dešava u prilično teškim uslovima.
Svaku jednačinu reakcije benzena možemo detaljnije razmotriti.
1. Elektrofilna supstitucija. Brom, u prisustvu katalizatora, reaguje sa hlorom. Kao rezultat, dobijamo hlorobenzen:
S6H6+3Cl2 → C6H5Cl + HCl
2. Friedel-Craftsova reakcija, ili alkilacija benzena. Do pojave alkilbenzena dolazi zbog kombinacije sa alkanima, koji su halogeni derivati:
C6H6 + C2H5Br → C6H5C2H5 + HBr
3. Elektrofilna supstitucija. Ovdje se odvija reakcija nitriranja i sulfoniranja. Jednačina za benzen će izgledati ovako:
C6H6 + H2SO4 → C6H5SO3H + H2O
C6H6 + HNO3 → C6H5NO2 + H2O
4. Benzen pri sagorevanju:
2C6H6 + 15O2 → 12CO2 + 6H2O
Pod određenim uslovima, pokazuje karakteristike zasićenih ugljovodonika. Oblak P-elektrona, koji se nalazi u strukturi dotične supstance, objašnjava ove reakcije.
Različite vrste benzena zavise od posebne tehnologije. Ovo je mjesto gdje je označen naftni benzen. Na primjer, pročišćeno i visoko pročišćeno, za sintezu. Želio bih posebno napomenuti homologe benzena, tačnije, njihova hemijska svojstva. To su alkilbenzeni.

Homolozi benzena reaguju mnogo spremnije. Ali gore navedene reakcije benzena, odnosno homolozi, odvijaju se s određenim razlikama.
Halogenacija alkilbenzena
Oblik jednačine je sljedeći:
C6H5-CH3 + Br = C6H5-CH2Br + HBr.
Tendencija broma u benzenski prsten nije primećena. Izlazi u lanac sa strane. Ali zahvaljujući katalizatoru soli Al(+3), brom lako ulazi u prsten.
Nitracija alkilbenzena
Zahvaljujući sumpornoj i azotnoj kiselini, benzeni i alkilbenzeni su nitrirani. Reaktivni alkilbenzeni. Dobivaju se dva od tri predstavljena proizvoda - to su para- i orto-izomeri. Možete napisati jednu od formula:
C6H5 - CH3 + 3HNO3 → C6H2CH3 (NO2)3.
Oksidacija
Ovo je neprihvatljivo za benzen. Ali alkilbenzeni lako reaguju. Na primjer, benzojeva kiselina. Formula je data u nastavku:
C6H5CH3 + [O] → C6H5COOH.
Alkilbenzen i benzen, njihova hidrogenacija
U prisustvu pojačala, vodonik počinje da reaguje sa benzenom, što rezultira stvaranjem cikloheksana, kao što je gore objašnjeno. Slično, alkilbenzeni se lako pretvaraju u alkilcikloheksane. Da bi se dobio alkilcikloheksan, potrebno je hidrogenirati željeni alkilbenzen. Ovo je u osnovi neophodan postupak za proizvodnju čistog proizvoda. I to nisu sve reakcije benzena i alkilbenzena.
Proizvodnja benzena. Industrija
Osnova takve proizvodnje je prerada komponenti: toluena, nafte, katrana koji se oslobađa prilikom krekiranja uglja i dr. Stoga se benzol proizvodi u petrohemijskim i metalurškim preduzećima. Važno je znati kako dobiti benzen različitog stupnja čistoće, jer princip proizvodnje i namjena direktno zavise od marke ove supstance.
Lavovski udio se proizvodi termokatalitičkim reformiranjem dijela kaustobiolita, ključanjem na 65 stepeni, sa efektom ekstrakta, destilacijom sa dimetilformamidom.
Pri proizvodnji etilena i propilena dobijaju se tečni proizvodi koji nastaju pri razgradnji neorganskih i organskih jedinjenja pod uticajem toplote. Od njih je izolovan benzol. Ali, nažalost, nema toliko izvornog materijala za ovu opciju za ekstrakciju benzena. Dakle, supstanca koja nas zanima se ekstrahuje reformisanjem. Ovom metodom se povećava volumen benzena.

Dealkilacijom na temperaturi od 610-830 stepeni sa znakom plus, u prisustvu pare nastale ključanjem vode i vodonika, iz toluena se dobija benzen. Postoji još jedna opcija - katalitička. Kada se uoči prisustvo zeolita, ili, alternativno, oksidnih katalizatora, podvrgnutih temperaturnom režimu od 227-627 stepeni.
Postoji još jedna, starija, metoda za razvijanje benzena. Uz pomoć apsorpcije apsorbentima organskog porijekla, izoluje se od konačnog rezultata koksenog uglja. Proizvod je parno-gasni proizvod i prethodno je ohlađen. Na primjer, koristi se nafta čiji je izvor nafta ili ugalj. Kada se destilacija vrši parom, apsorbent se odvaja. Hidroobrada pomaže u uklanjanju viška tvari iz sirovog benzola.
Sirovine za ugalj
U metalurgiji se pri korištenju uglja, tačnije suhom destilacijom, dobiva koks. Tokom ove procedure, dovod vazduha je ograničen. Ne zaboravite da se ugalj zagrijava na temperaturu od 1200-1500 Celzijusa.
Hemikalija za ugalj benzol treba temeljito pročišćavanje. Imperativ je da se riješite metil cikloheksana i njegovog prijatelja n-heptana. takođe treba oduzeti. Benzen se suočava sa procesom odvajanja i prečišćavanja, koji će se izvoditi više puta.
Gore opisana metoda je najstarija, ali s vremenom gubi svoju visoku poziciju.
Uljne frakcije
0,3-1,2% - ovo su pokazatelji sastava našeg heroja u sirovoj nafti. Oskudni pokazatelji za ulaganje novca i truda. Za preradu naftnih frakcija najbolje je koristiti industrijski postupak. Odnosno, katalitičko reformisanje. U prisustvu aluminij-platina-renijumskog pojačivača povećava se postotak aromatičnih ugljikohidrata, a povećava se indikator koji određuje sposobnost goriva da se spontano ne zapali tijekom kompresije.
Pirolizne smole
Ako svoj naftni proizvod ekstrahiramo iz nečvrstih sirovina, odnosno pirolizom propilena i etilena koji nastaju u proizvodnji, onda će ovaj pristup biti najprihvatljiviji. Da budemo precizni, benzen se oslobađa iz pirokondenzata. Razgradnja u određenim razmerama zahteva hidrotretman. Tokom čišćenja uklanjaju se sumpor i nezasićene smjese. Početni rezultat je sadržavao ksilen, toluen i benzol. Koristeći destilaciju, koja je ekstraktivna, BTK grupa se odvaja da bi se dobio benzen.

Hidrodealkilacija toluena
Glavni karakteri procesa, koktel protoka vodika i toluena, ulaze zagrijani u reaktor. Toluen prolazi kroz sloj katalizatora. Tokom ovog procesa, metil grupa se odvaja da bi se formirao benzen. Ovdje je prikladna određena metoda čišćenja. Rezultat je visoko čista supstanca (za nitraciju).
Disproporcija toluena
Kao rezultat odbacivanja metilne klase, dolazi do stvaranja benzena, a ksilen se oksidira. U ovom procesu je uočena transalkilacija. Katalitički učinak nastaje zahvaljujući paladiju, platini i neodimijumu, koji se nalaze na aluminijskom oksidu.
Taluen i vodonik se dovode u reaktor sa stabilnim slojem katalizatora. Njegova svrha je da spriječi taloženje ugljikovodika na ravni katalizatora. Struja koja napušta reaktor se hladi, a vodonik se sigurno vraća za recikliranje. Ono što je ostalo se destiluje tri puta. U početnoj fazi uklanjaju se jedinjenja koja nisu aromatična. Benzen se ekstrahuje drugi, a poslednji korak je odvajanje ksilena.
Trimerizacija acetilena
Zahvaljujući radu francuskog fizičkog hemičara Marcelina Berthelota, benzen je počeo da se proizvodi iz acetilena. Ali ono što se izdvajalo je težak koktel mnogih drugih elemenata. Pitanje je bilo kako sniziti temperaturu reakcije. Odgovor je dobijen tek krajem četrdesetih godina 20. veka. V. Reppe je pronašao odgovarajući katalizator, ispostavilo se da je nikl. Trimerizacija je jedina opcija da se benzen dobije iz acetilena.

Benzen se formira pomoću aktivnog ugljena. Pri visokim nivoima toplote, acetilen prelazi preko uglja. Benzen se oslobađa ako je temperatura najmanje 410 stepeni. Istovremeno se rađaju i različiti aromatični ugljovodonici. Stoga vam je potrebna dobra oprema koja može efikasno očistiti acetilen. S takvom radno intenzivnom metodom kao što je trimerizacija, troši se puno acetilena. Da biste dobili 15 ml benzena, uzmite 20 litara acetilena. Možete vidjeti kako to izgleda i reakcija neće dugo potrajati.
3C2H2 → C6H6 (jednačina Zelinskog).
3CH → CH = (t, kat) = C6H6.
Gdje se koristi benzen?
Benzen je prilično popularna ideja hemije. Posebno se često zapažalo kako se benzen koristi u proizvodnji kumena, cikloheksana i etilbenzena. Da biste stvorili stiren, ne možete bez etilbenzena. Početni materijal za proizvodnju kaprolaktama je cikloheksan. Prilikom izrade termoplastične smole koristi se kaprolaktam. Opisana tvar je neophodna u proizvodnji raznih boja i lakova.
Koliko je benzen opasan?
Benzen je toksična supstanca. Manifestacija osjećaja malaksalosti, koja je praćena mučninom i jakom vrtoglavicom, znak je trovanja. Čak se i smrt ne može isključiti. Osjećaj neopisivog oduševljenja nije ništa manje alarmantno zvono za trovanje benzenom.
Benzen u tečnom obliku izaziva iritaciju kože. Pare benzena lako prodiru čak iu netaknutu kožu. Uz vrlo kratkotrajne kontakte sa supstancom u maloj dozi, ali na redovnoj osnovi, neugodne posljedice neće dugo trajati. To može biti oštećenje koštane srži i akutna leukemija raznih vrsta.

Osim toga, supstanca izaziva ovisnost kod ljudi. Benzen deluje kao droga. Duvanski dim proizvodi proizvod sličan katranu. Kada su ga proučavali, došli su do zaključka da njegov sadržaj nije bezbedan za ljude. Osim prisustva nikotina, otkriveno je i prisustvo aromatičnih ugljikohidrata kao što je benzpiren. Posebnost benzopirena je da je kancerogen. Imaju veoma štetno dejstvo. Na primjer, uzrokuju rak.
Uprkos navedenom, benzen je početna sirovina za proizvodnju raznih lijekova, plastike, sintetičke gume i, naravno, boja. Ovo je najčešća ideja hemije i aromatičnog spoja.
Cikličnu strukturu benzena prvi je predložio F.A. Kekule 1865. godine

Friedrich August Kekule von Stradonitz - izvanredni njemački hemičar 19. stoljeća. Godine 1854. otkrio je prvo organsko jedinjenje koje sadrži sumpor - tiooctenu kiselinu (tioetansku kiselinu). Osim toga, ustanovio je strukturu diazo jedinjenja. Međutim, njegov najpoznatiji doprinos razvoju hemije je uspostavljanje strukture benzena (1866). Kekulé je pokazao da se dvostruke veze benzena izmjenjuju oko prstena (ideja koja mu je pala na pamet u snu). Kasnije je pokazao da su dva moguća rasporeda dvostrukih veza identična i da je benzenski prsten hibrid između te dvije strukture. Tako je anticipirao ideju rezonancije (mezomerizma), koja se pojavila u teoriji kemijske veze ranih 1930-ih.
Ako bi benzen zaista imao takvu strukturu, onda bi njegovi 1,2-disupstituirani derivati trebali imati dva izomera. na primjer,

Međutim, nijedan od 1,2-disupstituiranih benzena ne može se izolirati u dva izomera.
Stoga je Kekule naknadno sugerirao da molekul benzena postoji kao dvije strukture koje se brzo transformiraju jedna u drugu:

Imajte na umu da takvi šematski prikazi molekula benzena i njihovih derivata obično ne ukazuju na atome vodika vezane za atome ugljika benzenskog prstena.
U savremenoj hemiji, molekul benzena se smatra rezonantnim hibridom ova dva ograničavajuća rezonantna oblika (videti odeljak 2.1). Drugi opis molekula benzena zasniva se na razmatranju njegovih molekularnih orbitala. In Sect. 3.1 naznačeno je da su -elektroni smješteni u -vezujućim orbitalama delokalizirani između svih atoma ugljika benzenskog prstena i formiraju oblak -elektrona. U skladu s ovim prikazom, molekula benzena se može konvencionalno prikazati na sljedeći način:
Eksperimentalni podaci potvrđuju prisustvo upravo takve strukture u benzenu. Ako je benzen imao strukturu koju je Kekulé prvobitno predložio, sa tri konjugirane dvostruke veze, onda bi benzen trebao proći kroz reakcije adicije poput alkena. Međutim, kao što je gore spomenuto, benzen ne prolazi kroz reakcije adicije. Osim toga, benzen je stabilniji nego da ima tri izolirane dvostruke veze. In Sect. 5.3 naznačeno je da entalpija hidrogenacije benzena da nastane cikloheksan ima veći negativan
Tabela 18.3. Dužina različitih veza ugljik-ugljik


Rice. 18.6. Geometrijska struktura molekula benzena.
vrijednost od trostruke entalpije hidrogenacije cikloheksena. Razlika između ovih veličina obično se naziva entalpija delokalizacije, rezonantna energija ili stabilizacijska energija benzena.
Sve veze ugljik-ugljik u benzenskom prstenu imaju istu dužinu, koja je kraća od dužine C-C veza u alkanima, ali duža od dužine C=C veza u alkenima (tabela 18.3). Ovo potvrđuje da su ugljik-ugljik veze u benzenu hibrid jednostruke i dvostruke veze.
Molekul benzena ima ravnu strukturu, što je prikazano na sl. 18.6.
Fizička svojstva
Benzen u normalnim uslovima je bezbojna tečnost koja se smrzava na 5,5 °C i ključa na 80 °C. Ima karakterističan ugodan miris, ali, kao što je već spomenuto, vrlo je toksičan. Benzen se ne miješa sa vodom i u benzenskom sistemu voda formira gornji od dva sloja. Međutim, rastvorljiv je u nepolarnim organskim rastvaračima i sam je dobar rastvarač za druga organska jedinjenja.
Hemijska svojstva
Iako benzen prolazi kroz određene reakcije adicije (vidi dolje), on ne pokazuje reaktivnost tipičnu za alkene. Na primjer, ne mijenja boju vode broma ili otopine -jona. Štaviše, benzen nije
ulazi u reakcije adicije sa jakim kiselinama, kao što su hlorovodonična ili sumporna kiselina.
Istovremeno, benzen učestvuje u brojnim reakcijama elektrofilne supstitucije. Produkti ove vrste reakcija su aromatična jedinjenja, jer se u ovim reakcijama zadržava delokalizovani elektronski sistem benzena. Opći mehanizam zamjene atoma vodika na benzenskom prstenu elektrofilom opisan je u odjeljku. 17.3. Primjeri elektrofilne supstitucije benzena su njegove nitriranje, halogeniranje, sulfoniranje i Friedel-Craftsove reakcije.
Nitracija. Benzen se može nitrirati (grupa koja mu se dodaje) tretiranjem mješavinom koncentriranih dušičnih i sumpornih kiselina:

Nitrobenzen
Uslovi za ovu reakciju i njen mehanizam opisani su u odjeljku. 17.3.
Nitrobenzen je blijedožuta tekućina s karakterističnim mirisom badema. Prilikom nitriranja benzena, osim nitrobenzena, nastaju i kristali 1,3-dinitrobenzena, koji je proizvod sljedeće reakcije:

Halogenacija. Ako pomiješate benzen sa hlorom ili bromom u mraku, neće doći do reakcije. Međutim, u prisustvu katalizatora koji posjeduju svojstva Lewisovih kiselina, u takvim smjesama dolazi do reakcija elektrofilne supstitucije. Tipični katalizatori za ove reakcije su željezo(III) bromid i aluminij hlorid. Djelovanje ovih katalizatora je da stvaraju polarizaciju u molekulima halogena, koji zatim formiraju kompleks s katalizatorom:
iako nema direktnih dokaza da se u ovom slučaju formiraju slobodni joni. Mehanizam bromiranja benzena upotrebom gvožđe(III) bromida kao nosača jona može se predstaviti na sledeći način:

Sulfoniranje. Benzen se može sulfonirati (zamijeniti atom vodonika sulfo grupom) refluksom njegove smjese s koncentriranom sumpornom kiselinom nekoliko sati. Umjesto toga, benzol se može pažljivo zagrijati u mješavini s dimećom sumpornom kiselinom. Dimljiva sumporna kiselina sadrži sumpor trioksid. Mehanizam ove reakcije može se prikazati dijagramom

Friedel-Craftsove reakcije. Friedel-Craftsove reakcije su izvorno nazvane kondenzacijske reakcije između aromatskih spojeva i alkil halogenida u prisustvu bezvodnog katalizatora aluminij klorida.
U reakcijama kondenzacije, dva molekula reagensa (ili jedan reagens) se međusobno spajaju, formirajući molekul novog spoja, dok se molekul nekog jednostavnog spoja, poput vode ili klorovodika, odvaja (eliminira) od njih.
Trenutno se Friedel-Craftsova reakcija naziva bilo koja elektrofilna supstitucija aromatičnog spoja u kojoj ulogu elektrofila igra karbokation ili visoko polarizirani kompleks s pozitivno nabijenim atomom ugljika. Elektrofilni agens je u pravilu alkil halid ili hlorid neke karboksilne kiseline, iako može biti i, na primjer, alken ili alkohol. Bezvodni aluminijum hlorid se obično koristi kao katalizator za ove reakcije. Friedel-Craftsove reakcije se obično dijele na dvije vrste: alkilaciju i acilaciju.
Alkilacija. U ovoj vrsti Friedel-Craftsove reakcije, jedan ili više atoma vodika na benzenskom prstenu su zamijenjeni alkil grupama. Na primjer, kada se mješavina benzena i hlorometana lagano zagrije u prisustvu bezvodnog aluminij hlorida, nastaje metilbenzen. Klorometan igra ulogu elektrofilnog agensa u ovoj reakciji. Polarizira ga aluminij hlorid na isti način kao što se to dešava s molekulima halogena:
Mehanizam reakcije koja se razmatra može se predstaviti na sljedeći način:

Treba napomenuti da se u ovoj reakciji kondenzacije između benzena i klorometana eliminira molekula klorovodika. Imajte na umu da je stvarno postojanje karbokationa metala u obliku slobodnog jona upitno.
Alkilacija benzena hlorometanom u prisustvu katalizatora - bezvodnog aluminijum hlorida ne dovodi do stvaranja metilbenzena. U ovoj reakciji dolazi do daljnje alkilacije benzenskog prstena, što dovodi do stvaranja 1,2-dimetilbenzena:

Acilacija. U ovoj vrsti Friedel-Craftsove reakcije, atom vodika na benzenskom prstenu je zamijenjen acilnom grupom, što rezultira stvaranjem aromatičnog ketona.
Acilna grupa ima opću formulu
Sistematski naziv acilnog jedinjenja nastaje zamjenom sufiksa i završetka -ova u nazivu odgovarajuće karboksilne kiseline, čiji je derivat ovo acilno jedinjenje, sufiksom -(o)il. Na primjer

Acilacija benzena se provodi korištenjem klorida ili anhidrida bilo koje karboksilne kiseline u prisustvu katalizatora, bezvodnog aluminij klorida. Na primjer

Ova reakcija je kondenzacija u kojoj se eliminira molekula klorovodika. Imajte na umu da se naziv "fenil" često koristi za označavanje benzenskog prstena u jedinjenjima u kojima benzen nije glavna grupa:

Reakcije sabiranja. Iako benzen najviše karakteriziraju reakcije elektrofilne supstitucije, on također prolazi kroz neke reakcije adicije. Jednog od njih smo već upoznali. Govorimo o hidrogenaciji benzena (vidi odjeljak 5.3). Kada se mješavina benzena i vodonika prođe preko površine fino mljevenog nikalnog katalizatora na temperaturi od 150-160 °C, dolazi do čitavog niza reakcija koje se završavaju stvaranjem cikloheksana. Ukupna stehiometrijska jednačina za ovu reakciju može se predstaviti na sljedeći način:

Kada je izložen ultraljubičastom zračenju ili direktnoj sunčevoj svjetlosti, benzen također reagira s hlorom. Ova reakcija se odvija preko složenog radikalnog mehanizma. Njegov konačni proizvod je 1,2,3,4,5,6-heksaklorocikloheksan:

Slična reakcija se događa između benzena i broma pod utjecajem ultraljubičastog zračenja ili sunčeve svjetlosti.
Oksidacija. Benzen i benzenski prsten u drugim aromatičnim jedinjenjima su, općenito govoreći, otporni na oksidaciju čak i tako jakim oksidantima kao što je kiseli ili alkalni rastvor kalijum permanganata. Međutim, benzol i druga aromatična jedinjenja sagorevaju u vazduhu ili kiseoniku da bi proizveli veoma zadimljen plamen, što je tipično za ugljikovodike sa visokim relativnim sadržajem ugljenika.

Homolozi benzena su sposobni da reaguju u dva smera uz učešće aromatičnog jezgra i bočnog lanca (alkil grupe), u zavisnosti od prirode reagensa.
1.Reakcije na aromatični prsten
Zbog donorskog efekta alkil grupe, S E ArH reakcije se odvijaju ortho- I par-pozicija aromatičnog prstena, dok su uslovi blaži nego za benzol.
a) halogeniranje

b) nitriranje


Primijetite kako, kako se broj akceptorskih grupa (-NO2) povećava, temperatura reakcija nitriranja raste.
c) sulfoniranje

Reakcija pretežno proizvodi n-izomer.
d) alkilacija

e) acilacija

2. Bočne lančane reakcije
Alkilni fragment molekule benzena ulazi u SR reakcije koje uključuju atom ugljika u α -pozicija (benzilna pozicija).


Oksidacija svih homologa benzena sa KMnO 4 /100°C dovodi do stvaranja benzojeve kiseline.
Zgusnute arene

Kondenzovani areni su aromatični sistemi (n=2 i 3). Stepen aromatičnosti kondenzovanih arena je niži nego kod benzena. Karakteriziraju ih reakcije elektrofilne supstitucije, reakcije adicije i reakcije oksidacije, koje se javljaju u blažim uvjetima nego za benzen.
Reaktivnost naftalena
S E ArH reakcije za naftalen se odvijaju uglavnom prema α -pozicija, sa izuzetkom sulfoniranja. Elektrofilno dodavanje Ad E se dešava na 1,4 pozicijama, pri čemu naftalen pokazuje svojstva konjugovanih diena.
1. Elektrofilne supstitucijske reakcije,S E ArH


2.Reakcije elektrofilnog dodavanja, redukcije i oksidacije.


Reaktivnost antracena i fenantrena
Reakcije elektrofilne supstitucije, S E ArH i elektrofilne adicije, Ad E za antracen se dešavaju pretežno na pozicijama 9 i 10 (vidi dijagram ispod).

Reakcije elektrofilne supstitucije, S E ArH i elektrofilne adicije, Ad E za fenantren se dešavaju pretežno na pozicijama 9 i 10, kao i za antracen (vidi dijagram ispod).

Reakcije oksidacije i redukcije za antracen i fenantren.


Strukture nekih lijekova na bazi naftalena, antracen i fenantren
Naphthyzin(nafazolin, sanorin)

vazokonstriktorski efekat(liječenje rinitisa, sinusitisa)
(originalna struktura je naglašena u naslovu, obratite pažnju na numeraciju)
Naftifin

antifungalni djelovanje (liječenje dermatitisa)
Nabumeton

protuupalno, antipiretičko, analgetsko djelovanje(liječenje osteoartritisa, reumatoidnog artritisa).
Nadolol

(izraz cis, u ovom slučaju, označava relativni položaj hidroksilnih grupa)
hipotenzivna(snižava krvni pritisak) i antiaritmički efekat
Morfijum, kodein

Test pitanja za poglavlje "ARENAS"
1. Koja svojstva benzena razlikuju od ostalih nezasićenih jedinjenja - alkena, alkina? Šta znači pojam "aromatično jedinjenje"?
2. Napišite strukturne formule jedinjenja: a) etilbenzena; b) 1,3-dimetilbenzen ( m -ksilen); c) 1,3,5-trimetilbenzen (mesitilen); d) izopropilbenzen (kumen); e) 3-fenilpentan; f) vinilbenzen (stiren); g) fenilacetilen; h) trans -difeniletilen ( trans -stilbene).
3. Opišite strukturne karakteristike jedinjenja koja pokazuju aromatičnost. Formulirajte Hückelovo pravilo. Koja od sljedećih jedinjenja su aromatična:

4. Uporedite odnos cikloheksena i benzena sa sledećim reagensima pod određenim uslovima : a) Br 2 (H 2 O, 20 C); b) KMnO 4 (H 2 O.0 C); c) N 2 SO 4 (konc.) , 20 C; d) H 2 (Pd, 30 C); d) O 3 , zatim H 2 O(Zn); f) HBr.
5. Napišite strukturne formule monosupstituiranih benzena nastalih u reakcijama benzena sa sljedećim reagensima: a) N 2 SO 4 (konc.); b) HNO 3 ; N 2 SO 4 (konc.); c) Br 2 /Fe; d) Kl 2 /AlCl 3 ; e) CH 3 Br/AlBr 3 ; e) CH 3 COCl/AlCl 3 . Imenujte reakcije i njihove produkte. Navedite s kojim elektrofilom benzen reagira u svakom konkretnom slučaju.
6. Dajte opštu shemu za interakciju benzena sa elektrofilnim reagensom ( E + ). Imenujte intermedijarne komplekse. Koji korak obično određuje brzinu reakcije? Dajte grafikon promjene potencijalne energije reakcije koja se razmatra.
7. Definišite sledeće pojmove: a) prelazno stanje; b) međuveza; c) -kompleks; d)-kompleks. Koje od njih su identične? Ilustrirajte ove koncepte na primjeru bromiranja benzena u prisustvu katalizatora. FeBr 3 .
8. Na primjeru reakcija etena i benzena sa bromom uporedi mehanizam elektrofilne adicije u alkenima sa mehanizmom elektrofilne supstitucije u aromatičnom nizu. U kojoj fazi se uočava razlika i zašto?
9. Koristeći induktivne i mezomerne efekte, opišite interakciju supstituenta sa benzenskim prstenom u naznačenim jedinjenjima:

Označite supstituente koji doniraju elektrone (ED) i povlače elektrone (EA).
10. Napišite šeme za mononitraciju jedinjenja: a) fenola; b) benzensulfonske kiseline; c) izopropilbenzen; d) hlorobenzen. Za koje jedinjenje bi relativna stopa zamjene trebala biti najveća i zašto?
11. Formiranje kojih proizvoda treba očekivati tokom monosulfoniranja jedinjenja: a) toluena; b) nitrobenzen; c) benzojeva kiselina; d) bromobenzen? Koje jedinjenje bi trebalo najlakše sulfonirati? Zašto?
12. Rasporedite sljedeća jedinjenja po rastućoj reaktivnosti prilikom njihovog bromiranja u benzenski prsten: a) benzol; b) fenol; c) benzaldehid; d) etilbenzen. Dajte objašnjenje.
13. Navedite sljedeće ugljovodonike:

14. Napišite reakcije benzena sa sljedećim reagensima : a) Cl 2 (Fe); b) 3Cl 2 (svjetlo); c) HNO 3 (H 2 SO 4 ); d) O 2 (vazduh) (V 2 O 5 , 450 C); e) 3O 3 , zatim N 2 O (Zn); e) H 2 SO 4 (oleum); g) 3H 2 (Ni, 200 C,str ). Koje su karakteristike adicijskih reakcija u benzenu?
15. Napišite reakcije toluena sa naznačenim reagensima : a) 3H 2 (Ni, 200 C, 9806,7 kPa); b) KMnO 4 V N 2 O; c*) Cl 2 , svjetlo; d*) Cl 2 (Fe); e*) CH 3 Cl(AlCl 3 ); e*) CH 3 COCl (AlCl 3 ); g) HNO 3 (H 2 SO 4 ). Za reakcije označene zvjezdicom navedite mehanizme.
16. Napišite reakcije nitriranja etilbenzena pod navedenim uslovima: a) 65% HNO 3 +H 2 SO 4 (konc.); b) 10% HNO 3 , grijanje, pritisak. Donesite mehanizme.
17. Uporedite odnos izopropilbenzena i broma: a) u prisustvu AlBr 3 ; b) pod rasvjetom i grijanjem. Navedite reakcije i njihove mehanizme.
18. Koja jedinjenja nastaju iz etilbenzena i n -ksilen pod dejstvom navedenih oksidacionih sredstava: a) O 3 , zatim H 2 O (Zn); b) KMnO 4 u H 2 O,t ; c) K 2 Cr 2 O 7 u H 2 SO 4 , t ?
19. Po kojim reakcijama se mogu razlikovati sljedeći parovi jedinjenja: a) etilbenzen i m -ksilen; b) etilbenzol i stiren; c) stiren i fenilacetilen; G) O - I n -ksileni?
20. Koja jedinjenja su produkti reakcija u nastavku:

21. Na osnovu benzena i bilo kojeg drugog reagensa, dobiti jedinjenja u nastavku: a) n -trlja -butiltoluen; b) etil- n -tolil keton; c) alilbenzen; G) n -bromobenzojeva kiselina.
22. Navedite glavna jedinjenja koja nastaju u sljedećim reakcijama:

Prva grupa reakcija su supstitucijske reakcije. Rekli smo da areni nemaju višestruke veze u strukturi molekula, već sadrže konjugovani sistem od šest elektrona, koji je veoma stabilan i daje dodatnu snagu benzenskom prstenu. Stoga se u kemijskim reakcijama prvo događa zamjena atoma vodika, a ne uništavanje benzenskog prstena.
Već smo se susreli sa supstitucijskim reakcijama kada smo govorili o alkanima, ali kod njih su te reakcije išle po radikalnom mehanizmu, dok arene karakteriše jonski mehanizam supstitucijskih reakcija.
Prvo hemijska svojstva halogenacije. Zamjena atoma vodika atomom halogena, hlora ili broma.
Reakcija se odvija pri zagrijavanju i uvijek uz učešće katalizatora. U slučaju hlora, to može biti aluminijum hlorid ili željezni hlorid tri. Katalizator polarizira molekul halogena, uzrokujući heterolitičko cijepanje veze i proizvodnju iona.
Klor je pozitivno nabijen ion i reagira s benzenom.
Ako se reakcija odvija s bromom, tada je katalizator željezni bromid ili aluminij bromid.

Važno je napomenuti da se reakcija odvija s molekularnim bromom, a ne s bromnom vodom. Benzen ne reaguje sa bromnom vodom.
Halogenacija homologa benzena ima svoje karakteristike. U molekulu toluena, metil grupa olakšava supstituciju u prstenu, reaktivnost se povećava, a reakcija se odvija u blažim uslovima, odnosno na sobnoj temperaturi.

Važno je napomenuti da se supstitucija uvijek dešava u orto i para pozicijama, tako da se dobija mješavina izomera.
Drugo svojstvo nitracije benzena, uvođenje nitro grupe u benzenski prsten.

Teška žućkasta tečnost sa mirisom gorkog badema nastaje nitrobenzen, pa reakcija može biti kvalitativna za benzol. Za nitriranje se koristi nitrirajuća mješavina koncentrirane dušične i sumporne kiseline. Reakcija se izvodi zagrijavanjem.
Da podsjetim da je za nitraciju alkana u Konovalovskoj reakciji korištena razrijeđena dušična kiselina bez dodatka sumporne kiseline.
Prilikom nitriranja toluena, kao i prilikom halogeniranja, nastaje mješavina orto- i para-izomera.

Treće svojstvo alkilacije benzena sa haloalkanima.

Ova reakcija omogućava uvođenje ugljikovodičnih radikala u benzenski prsten i može se smatrati metodom za proizvodnju homologa benzena. Aluminij hlorid se koristi kao katalizator, koji pospješuje razgradnju molekula haloalkana na ione. Grijanje je također neophodno.
Četvrto svojstvo alkilacije benzena sa alkenima.

Na ovaj način možete dobiti, na primjer, kumen ili etilbenzol. Katalizator aluminijum hlorid.
2. Reakcije adicije na benzol
Druga grupa reakcija su reakcije adicije. Rekli smo da ove reakcije nisu tipične, ali su moguće pod prilično strogim uslovima uz uništavanje oblaka pi-elektrona i formiranje šest sigma veza.
Peto svojstvo u općoj listi hidrogenacija, dodavanje vodonika.
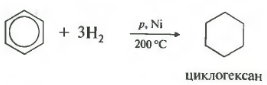
Temperatura, pritisak, katalizator nikl ili platina. Toluen može reagirati na isti način.
Šesto hlorisanje imovine. Imajte na umu da govorimo konkretno o interakciji s hlorom, jer brom ne ulazi u ovu reakciju.

Reakcija se javlja pod jakim ultraljubičastim zračenjem. Nastaje heksahlorocikloheksan, drugo ime za heksahloran, čvrstu supstancu.
Važno je to zapamtiti za benzen nije moguće reakcije adicije halogenovodonika (hidrohalogenacija) i dodavanja vode (hidratacija).
3. Zamjena u bočnom lancu homologa benzena
Treća grupa reakcija odnosi se samo na homologe benzena - ovo je supstitucija u bočnom lancu.
Sedmo svojstvo u općoj listi halogenacije na alfa atomu ugljika u bočnom lancu.

Reakcija se događa kada se zagrije ili ozrači i uvijek samo na alfa ugljiku. Kako se halogenacija nastavlja, drugi atom halogena će se vratiti u alfa položaj.
4. Oksidacija homologa benzena
Četvrta grupa reakcija je oksidacija.
Benzinski prsten je prejak, pa benzen ne oksidira kalijum permanganat ne mijenja boju svoje otopine. Ovo je veoma važno zapamtiti.
Ali homolozi benzena se oksidiraju zakiseljenom otopinom kalijevog permanganata kada se zagrijavaju. A ovo je osmo hemijsko svojstvo.

Time nastaje benzojeva kiselina. Primjećuje se promjena boje otopine. U ovom slučaju, bez obzira koliko je dugačak ugljični lanac supstituenta, on se uvijek prekida nakon prvog atoma ugljika i alfa atom se oksidira u karboksilnu grupu uz stvaranje benzojeve kiseline. Ostatak molekule se oksidira u odgovarajuću kiselinu ili, ako je samo jedan atom ugljika, u ugljični dioksid.
Ako homolog benzena ima više od jednog supstituenta ugljikovodika na aromatičnom prstenu, tada se oksidacija događa prema istim pravilima: ugljik koji se nalazi u alfa položaju se oksidira.

Ovaj primjer proizvodi dvobazičnu aromatičnu kiselinu koja se zove ftalna kiselina.
Posebno bih istakao oksidaciju kumena, izopropilbenzena, atmosferskim kiseonikom u prisustvu sumporne kiseline.

Ovo je takozvana kumenska metoda za proizvodnju fenola. U pravilu se na ovu reakciju susrećemo u pitanjima vezanim za proizvodnju fenola. Ovo je industrijska metoda.
Deveto svojstvo sagorijevanja, potpuna oksidacija kisikom. Benzen i njegovi homolozi sagorevaju u ugljični dioksid i vodu.
Napišimo jednačinu sagorevanja benzena u opštem obliku.
Prema zakonu održanja mase, na lijevoj strani treba biti onoliko atoma koliko je atoma na desnoj strani. Jer u kemijskim reakcijama atomi ne nestaju, već se redoslijed veza između njih jednostavno mijenja. Dakle, biće onoliko molekula ugljičnog dioksida koliko ima atoma ugljika u molekuli arena, budući da molekula sadrži jedan atom ugljika. To jest, n CO 2 molekula. Biće dva puta manje molekula vode nego atoma vodonika, odnosno (2n-6)/2, što znači n-3.
Na lijevoj i desnoj strani nalazi se isti broj atoma kisika. Na desnoj strani nalazi se 2n iz ugljičnog dioksida, jer svaka molekula ima dva atoma kisika, plus n-3 iz vode, ukupno 3n-3. Na lijevoj strani nalazi se isti broj atoma kisika 3n-3, što znači da ima dva puta manje molekula, jer molekul sadrži dva atoma. To je (3n-3)/2 molekula kiseonika.
Tako smo sastavili jednačinu za sagorevanje homologa benzena u opštem obliku.